题目内容
11.草酸亚铁晶体(FeC2O4•2H2O,相对分子质量180g)是一种浅黄色晶体,难溶于水,受热分解(文献显示其及应方程式为FeC2O4•2H2O═FeO+CO↑+CO2↑+2H2O).某化学兴趣小组设计如图装置,探究草酸亚铁晶体的分解反应
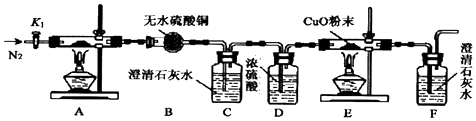
(1)该装置存在的明显缺陷没有处理尾气中的CO气体,会造成大气污染.
(2)设计实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃E处的酒精灯,再点燃A处的酒精灯.
(3)实验过程中,证明分解生成CO2的现象是C中澄清石灰水变浑浊;而E处黑粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有NaOH溶液的洗气瓶.
(4)实验结束后,有同字打开K1,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置C、F中的沉徒过滤、洗涤、干燥、称量,测得C中沉淀质量大约是F中的3倍,重新实验得出的实验结果不变.小组以成员经过讨论排除澄清石灰水不足造成的影响,提出三个假设:
a.CO在装置E中没有完全氧化.
b.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2
c.草酸亚铁分解时,有部分CO被FeO氧化为CO2
小组成员于是设计如下方案验证:
①验证假设a:在E之后再增加一个相同装罝E,并增加E中CuO的量,重新实验,所得数据只有微小变化,但不足以影响实验结果,说明假设a不成立.
②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的KSCN 或NH4SCN溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立
③验证假设c:取实验后A中固体溶于盐酸,产生气体,证明假设c成立.
④实验时同时测出下列有关数据:FeC2O4•2H2O的质量为10.80g,A中剩余固体的质量
为3.84g,测得实验结束后装置A中n(FeO)=0.03.
(5)根据实验分析,写出装置A中发生的总反应方程式FeC2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe+FeO+CO↑+3CO2↑+2H2O.由于实验的分解方程式与文献不同,实验小组再次经过讨论,利用原有实验装置图,对实验步骤略作改动,再次进行实验,得出与文献一致的反应方程式,请你写出改动部分的实验步骤打开活塞K1,通入一段时间的N2,不关闭活塞K1.
分析 检查装置的气密性,打开活塞K1,通入一段时间的N2,再关闭活塞K1,先点燃E处酒精灯,再点燃A处酒精灯,装置A中反应反应的方程式为FeC2O4•2H2O═FeO+CO↑+CO2↑+2H2O,通过装置B中无水硫酸铜检验吸收生成的水蒸气,通过装置C中澄清石灰水检验并吸收生成的二氧化碳,通过装置D中的浓硫酸干燥气体,通过装置E,一氧化碳和氧化铜发生反应,生成铜和二氧化碳,通过装置F中澄清石灰水检验生成的二氧化碳气体,证明有一氧化碳气体生成,
(1)一氧化碳有毒,扩散到空气中会污染环境;
(2)检查装置的气密性,打开活塞K1,通入一段时间的N2,再关闭活塞K1,排净装置内的空气,为更好啊的检验生成的一氧化碳气体,先点燃E处酒精灯;
(3)二氧化碳能使装置B中澄清石灰水变浑浊;E处黑粉末变红,证明草酸亚铁分解产中CO,为保证检验的准确性,在CD间增加除去二氧化碳气体的装置;
(4)亚铁离子被氧化为铁离子变质,利用铁离子遇到KSCN溶液会生成红色溶液; 氧化亚铁氧化一氧化碳会生成铁;结合碳元素守恒和碳元素守恒列式计算;
(5)实验分析可知晶体分解生成的产物为二氧化碳、一氧化碳、水、氧化亚铁、铁,反应后固体为铁和亚铁,避免生成铁,可以使装置中充满氮气;
解答 解:(1)从环保角度考虑,该套实验装置的明显缺陷是没有处理尾气.没有处理尾气中的CO气体,会造成大气污染,
故答案为:没有处理尾气中的CO气体,会造成大气污染;
(2)实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃E处酒精灯,再点燃A处酒精灯,更好的检验一氧化碳气体的存在,
故答案为:E、A;
(3)实验过程中,证明分解生成CO2的现象是C中澄清石灰水变浑浊,而E处黑粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有NaOH溶液的洗气瓶,用来除净生成的二氧化碳气体,
故答案为:C中澄清石灰水变浑浊;NaOH;
(4)②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的KSCN 或NH4SCN溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立,
③验证假设c:草酸亚铁分解时,有部分CO被FeO氧化为CO2,反应过程中有Fe生成,取实验后A中固体溶于盐酸,产生气体,说明生成了铁,证明假设c成立,
④分析可知晶体分解生成的产物为二氧化碳、一氧化碳、水、氧化亚铁、铁,反应后固体为铁和亚铁,
实验时同时测出下列有关数据:FeC2O4•2H2O的质量为10.80g,其物质的量n=$\frac{10.80g}{80g/mol}$=0.06mol,A中剩余固体的质量为3.84g,设生成Fe物质的量为x,FeO物质的量为y,
x+y=0.06mol
56x+72y=3.84g
x=0.03mol
y=0.03mol
测得实验结束后装置A中n(FeO)=0.03mol,
故答案为:KSCN 或NH4SCN;气体;0.03;
(5)实验分析可知晶体分解生成的产物为二氧化碳、一氧化碳、水、氧化亚铁、铁,反应后固体为铁和亚铁,测得C中沉淀质量大约是F中的3倍,碳元素守恒说明二氧化碳物质的量是一氧化碳物质的量的3倍,反应的化学方程式为:FeC2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe+FeO+CO↑+3CO2↑+2H2O,
文献中发生的反应的化学方程式:FeC2O4•2H2O═FeO+CO↑+CO2↑+2H2O,实验步骤中改动打开活塞K1,通入一段时间的N2,不关闭活塞K1,始终充满氮气环境进行反应,避免部分CO被FeO氧化为CO2,同时生成Fe,
故答案为:FeC2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe+FeO+CO↑+3CO2↑+2H2O,开活塞K1,通入一段时间的N2,不关闭活塞K1.
点评 本题考查了物质反应产物的实验探究、反应现象分析判断、实验结论的探究和实验验证设计,掌握基础是解题关键,题目难度中等.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 3 | B. | 4 | C. | 6 | D. | 8 |
| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |

金属阳离子在常温下以氢氧化物的形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 6.6 | 5.2 | 4.4 |
| 沉淀完全时的pH | 3.7 | 8.9 | 8.1 | 5.7 |
(1)为了加快锌矿石培烧的速率,可采取的措施有将锌矿石粉碎成细颗粒(回答一点即可).
(2)试剂A是-种由两种元素组成的液态“绿色”氧化剂,则加入试剂A后发生反应的离子方程式为2Fe2++2H++H2O2=2 Fe3++2H2O;试剂B最好选用ZnO或ZnCO3或Zn(OH)2,pH的调控范围为3.7≤pH<4.4.
(3)试剂C是Zn;电解产物中有一种物质可循环使用,该物质是H2SO4.
(4)酸浸时,ZnFe2O4会生成两种盐,该反应的化学方程式为ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O.
(5)沉积物中除生成的沉淀外还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因可能是Fe(OH)3胶体(沉淀)具有吸附性.
(6)若0.1t锌焙砂通过上述流程处理后最终得到了21.4kg沉淀物,则锌焙砂中铁元素的质量分数最大为11.2%.
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量.
(二)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂淀粉溶液(填名称),浓度为8.00×10-3mol•L-1的I2标准溶液、蒸馏水等.
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用.
(4)用酸式滴定管(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂.
(5)用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到滴定终点.滴定至终点时的现象是最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色.
(五)数据记录与处理
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
(六)问题讨论
(7)从分析数据看,此软包装橙汁是否是纯天然橙汁?不是(填“是”或“不是”或“可能是”,1分).生产商最可能采取的做法是B(填编号):
A.加水稀释天然橙汁 B.将维生素C作为添加剂 C.橙汁已被浓缩.