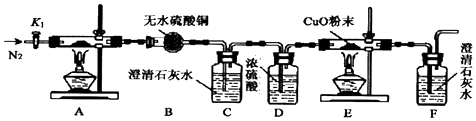
题目内容
19.乙二酸(HOOC-COOH)也称草酸,是一种重要的化工原料和化工产品.利用石油化工产品中的烷烃可以生成草酸,生产流程如图: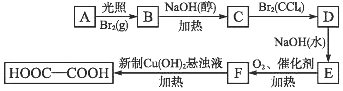
已知上述框图中有机物B的相对分子质量比有机物A的相对分子质量大79.
请回答下列问题:
(1)A的结构简式是CH3CH3;D的名称CH2BrCH2Br.
(2)写出有关的化学方程式:
B→C:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O
D→E:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr
(3)A生成B的反应类型是取代反应;C生成D的反应类型是加成反应.
分析 由合成乙二酸的流程可知,乙二酸由E经两步氧化而得,且碳原子数均为2,则F为OHC-CHO,E为HOCH2CH2OH,再结合C→D→E的反应条件可知D为CH2BrCH2Br,C发生加成反应生成D,C为CH2=CH2,而C由B经消去反应而得到的,则B应为CH3CH2Br,A发生取代反应生成B,A为CH2CH3,且溴乙烷的相对分子质量比乙烷大79,符合题意,以此来解答.
解答 解:(1)A的结构简式是CH3CH3,D为CH2BrCH2Br,其名称为1,2--二溴乙烷,故答案为:CH3CH3;CH2BrCH2Br;
(2)B→C的反应为CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,D→E的反应为CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr,
故答案为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O;CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr;
(3)A生成B的反应类型是取代反应;C生成D的反应类型是加成反应,故答案为:取代反应;加成反应.
点评 本题考查有机物的合成,为高频考点,把握合成流程中碳链变化、官能团变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
7.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物.它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
8.牙膏是由粉状摩擦剂、湿润剂、表面活性剂、粘合剂、香料、甜味剂及其它特殊成分构成的.经查文献获悉,某品牌牙膏中摩擦剂由碳酸钙、氢氧化铝组成,牙膏中其它成分不与酸、碱反应.
I.测定牙膏中摩擦剂碳酸钙的含量:利用如图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数.图中夹持仪器略去.
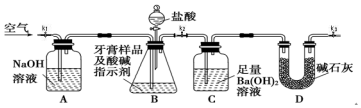
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水.打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气.
b.裝好药品后,关闭K1和K3、打开K2.打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气.
c.短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气.
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取20.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为20.0%.
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
I.测定牙膏中摩擦剂碳酸钙的含量:利用如图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数.图中夹持仪器略去.

依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水.打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气.
b.裝好药品后,关闭K1和K3、打开K2.打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气.
c.短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气.
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取20.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为20.0%.
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
5.在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
①试比较:K1>K2(填“>”、“=”或“<”)
②400℃时,其逆反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为:2.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,其逆反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为:2.