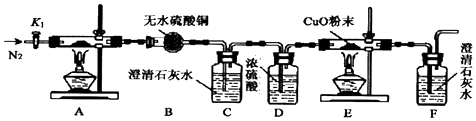
题目内容
16.煤干馏可以制得苯、甲苯、二甲苯等重要的化工原料,其中甲苯的二溴代物共有(不含立体异构)( )| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |
分析 采取分类讨论书写法,当两个Br取代甲基上的H时、当有一个溴取代甲基上的H,另外一个溴取代苯环上的H时、当2个溴都取代苯环上的H时分别有多少中结构,注意不能重复书写,以此解答该题.
解答 解:甲苯中,①当两个Br取代甲基上的H时有1种结构;
②当有一个溴取代甲基上的H,另外一个溴取代苯环上的H,苯环上可以有邻、间、对3种位置,故二溴代物有3种结构;
③当2个溴都取代苯环上的H时,采用定一议二的方法,当其中一个溴在甲基的邻位时,另外一个溴还有4种位置,故此二溴代物有4种结构;当其中一个溴在甲基的间位时,另一个溴有2种位置,故二溴代物有2种结构,
综上所述,二溴代物的结构有1+3+4+2=10种,
故选B.
点评 本题考查了同分异构体的书写,为高频考点,侧重考查学生的分析能力,中等难度,解题关键要搞清取代基的异构体及等效H原子判断.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
7.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物.它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
1.碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
平衡时,NO的转化率ɑ(NO)=90%,
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g)?NaNO3(g)+ClNO(g)△H1<0(平衡常数为K1)
II:ZNO(g)+Cl(g)?2ClNO(g)△H2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g)?2NaNO2(g)+2NO(g)+Cl2(g)△H3 (平衡常数为K3)
反应III中K3=$\frac{{K}_{1}^{2}}{{K}_{2}}$(用K1、K2表示),△H3=2△H1-△H2(用△H1、△H2表示).若反应 II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是AD.
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如表:
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
此溫度下,该反应的平衡常数K=5000.
(3)科学家提出由CO2制取C的工艺如图1所示.已知:在重整系统中n(FeO):n(CO2)=5:1则在“热分解系统”中,FexOy的化学式为Fe5O7.

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图2所示(M、N为多孔电极).为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3.电解时M和电源负 极(填“正或负”)相连,书写N极发生的电极反应式.
8.牙膏是由粉状摩擦剂、湿润剂、表面活性剂、粘合剂、香料、甜味剂及其它特殊成分构成的.经查文献获悉,某品牌牙膏中摩擦剂由碳酸钙、氢氧化铝组成,牙膏中其它成分不与酸、碱反应.
I.测定牙膏中摩擦剂碳酸钙的含量:利用如图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数.图中夹持仪器略去.
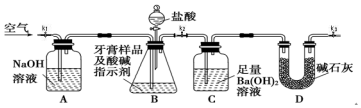
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水.打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气.
b.裝好药品后,关闭K1和K3、打开K2.打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气.
c.短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气.
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取20.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为20.0%.
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
I.测定牙膏中摩擦剂碳酸钙的含量:利用如图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数.图中夹持仪器略去.

依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水.打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气.
b.裝好药品后,关闭K1和K3、打开K2.打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气.
c.短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气.
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取20.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为20.0%.
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
15.某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如图实验.
实验Ⅰ:

(1)无色气体为NH3.
(2)该固体混合物的成分为NH4I、MgBr2、AlCl3.
实验Ⅱ:取一定量的该固体混合物溶于水配成1L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示.
(3)a=0.15.
(4)原固体混合物中各组成成分的物质的量之比为.
实验Ⅰ:

(1)无色气体为NH3.
(2)该固体混合物的成分为NH4I、MgBr2、AlCl3.
实验Ⅱ:取一定量的该固体混合物溶于水配成1L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示.
| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
(4)原固体混合物中各组成成分的物质的量之比为.
2.在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如表:下列说法正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T1时0~10 min NO2的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | T2时CH4的平衡转化率为70.0% | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大 |
 .B的离子结构示意图:
.B的离子结构示意图: .D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg.
.D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg. .
.