题目内容
3.运用外界条件对化学反应速率的影响理论,判断下列叙述正确的是( )| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
分析 A.高温条件下,钠和氧气反应生成过氧化钠;
B.常温下,铜和稀硝酸反应生成NO,和浓硝酸反应生成二氧化氮;
C.原电池能加快反应速率;
D.增大压强,增大正逆反应速率.
解答 解:A.常温下,钠和氧气反应生成氧化钠,高温条件下,钠和氧气反应生成过氧化钠,所以该结论错误,故A不选;
B.常温下,铜和稀硝酸反应生成NO,和浓硝酸反应生成二氧化氮,所以浓度影响产物,则该结论错误,故B不选;
C.Zn置换出Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快反应速率,故C选;
D.增大压强,体积减小,增大单位体积内活化分子个数,所以增大正逆反应速率,故D不选;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确外界条件对反应速率影响原理是解本题关键,易错选项是AB,注意反应条件、反应物浓度可能对产物的影响,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.浓度为2.00mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
| A. | 蒸发掉0.5L水 | B. | 标况下通入44.8L HCl气体 | ||
| C. | 将溶液加热蒸发浓缩至0.5L | D. | 加入6mol/L盐酸1L |
14.分析下列反应在任何温度下均能自发进行的是( )
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
11.下说法错误的是( )
| A. | 二氧化碳是温室气体,但不是大气污染物 | |
| B. | 农村常用明矾净水,是利用了胶体的性质 | |
| C. | 食品添加剂对人体无害,可大量食用 | |
| D. | 氯化钠是常用的防腐剂 |
8.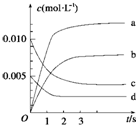 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
(1)如图表示NO2的变化的曲线是b.0~2s内,用O2表示的该反应的速率v(O2)0.0015mol•L-1•s-1
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
15.胶体粒子的直径,最接近于下列哪一个数值( )
| A. | 1×1010cm | B. | 1×10-8m | C. | 1×10-10cm | D. | 1×10-10m |