题目内容
14.分析下列反应在任何温度下均能自发进行的是( )| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
分析 反应自发进行的判断依据是:△H-T△S<0,分析选项是否符合要求.
解答 解:A、反应是吸热反应△H>0,△S<0,任何温度下不能自发进行,故A错误;
B、反应是放热反应△H<0,△S<0,低温下不能自发进行,故B错误;
C、反应是吸热反应△H>0,△S>0,低温下不能自发进行,故C错误;
D、反应是放热反应△H<0,△S>0,任何温度下都能自发进行,故D正确;
故选:D.
点评 本题考查了反应自发进行的判断依据应用,注意反应自发进行的判断由焓变、熵变、温度共同决定,题目较简单.

练习册系列答案
相关题目
5.在电解水时,为了增强导电性,加入的电解质最好选用( )
| A. | NaOH | B. | HCl | C. | NaCl | D. | CuSO4 |
2.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3•H2O |
19.在相同温度下,等体积、等物质的量浓度的四种溶液:①Na2SO4②H2SO3③NaHSO3④Na2S,其中所含带电粒子数由多到少的顺序是( )
| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |
6.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
3.运用外界条件对化学反应速率的影响理论,判断下列叙述正确的是( )
| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑如果有5molH2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142gNa2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
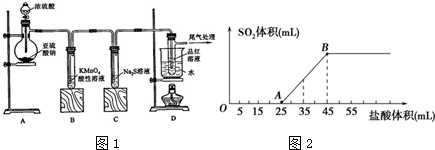
 .
. .
.