题目内容
8.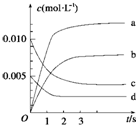 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
分析 (1)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,根据一氧化氮和二氧化氮之间转化关系式计算平衡时二氧化氮的物质的量,从而确定曲线;先计算一氧化氮的反应速率,再根据同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)为使该反应的反应速率增大,可采用增大压强、升高温度、加入催化剂、增大反应物浓度等方法,再结合平衡移动原理分析解答.
解答 解:(1)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=$\frac{0.013mol}{2L}$,故选b;
0~2s时,v(NO)=$\frac{\frac{(0.020-0.008)mol}{2L}}{2s}$=0.003mol/(L.s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=0.0015mol•L-1•s-1,
故答案为:b;0.0015;
(2)a、当v (NO2)=2v (O2)时,该反应不一定达到平衡状态,故错误;
b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故正确;
c、v逆(NO):v正(O2)=2:1时,该反应达到平衡状态,所以当v逆(NO)=2v正(O2),该反应达到平衡状态,故正确;
d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故错误;
故选bc;
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
点评 本题考查了化学平衡状态的判断、化学反应速率的计算等知识点,根据v=$\frac{△c}{△t}$、v(正)=v(逆)来分析解答即可,难度不大.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |
| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
| A. | 所得的分散系属于悬浊液 | B. | 所得的分散系中的分散质为Fe2O3 | ||
| C. | 给分散系通电时阳极周围黑色不变 | D. | 该分散系能产生丁达尔效应 |
| A. | Ca2+、K+、CO32-、Cl- | B. | Ba2+、Na+、SO42-、NO3- | ||
| C. | Ca2+、Na+、NO3-、Cl- | D. | H+、Na+、OH-、Cl- |
| A. | Na与H2O 的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径途径a比途径b放出更多热能途径途径a:C $→_{高温}^{H_{2}O}$CO+H2 $→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$ CO2 | |
| C. | FeCl3和MnO2均可 加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为热能 |
 4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.
4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题. ,气体分子(MN)2的电子式:
,气体分子(MN)2的电子式: ,X形成的离子的电子式:Mg2+.
,X形成的离子的电子式:Mg2+.