题目内容
10.弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.(1)生活中硫酸铁常作净水剂,其净水的原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示).(2)常温下,取0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出 MOH电离方程式:MOH?M++OH-.
(3)0.1mol/L的NaHA溶液显碱性.则该溶液中c(H2A)>c(A2-)(填“>”、“<”或“=”).
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol•L-1的Cr2O72-.为了使废水的排放达标,进行如下处理:
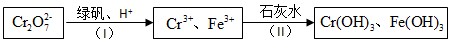
①绿矾为FeSO4•7H2O.反应(I)中Cr2O72-与FeSO4的物质的量之比为1:6.
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol•L-1,则处理后的废水的pH=6.(Ksp[Cr(OH)3]=6.0×10-31)
分析 (1)硫酸铁中含有铁离子,易水解生成氢氧化铁胶体,胶体吸附水中的悬浮物而净水;
(2)室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=5,说明得到的盐是强酸弱碱盐;
(3)NaHA溶液中,HA-离子既电离也水解,测得溶液显碱性,说明其电离程度小于水解程度;
(4)①依据氧化还原反应离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可以求得Cr2O72-与FeSO4的物质的量之比;
②据Ksp[Cr(OH)3]=6.0×10-31和c(Cr3+)=6.0×10-7 mol•L-1求得c(OH-)可求得pH.
解答 解:(1)硫酸铁中含有铁离子,易水解生成氢氧化铁胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以硫酸铁能净水,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,弱碱电离可逆,其电离方程式为:MOH?M++OH-,
故答案为:MOH?M++OH-;
(3)①NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,所以c(H2A)>c(A2-)
故答案为:>;
②NaHA溶液中,HA-离子既电离也水解,电离产生A2-,水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,
故答案为:NaHA溶液显碱性,说明其电离程度小于水解程度;
(4)①依据氧化还原反应离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O可以求得Cr2O72-与FeSO4的物质的量之比为1:6,
故答案为:1:6;
②Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=c3(OH-)×6.0×10-7=6.0×10-31 ,c(OH-)=1.0×10-8 ,其pH=6,
故答案为:6.
点评 本题考查了盐类水解的应用、氧化还原反应计算应用、溶度积的计算应用等知识点,题目综合性较强,题目难度较大,侧重于考查学生的分析能力和计算能力,注意把握盐的水解原理和弱电解质的电离特点以及氧化还原反应计算方法.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
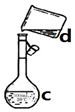 (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图