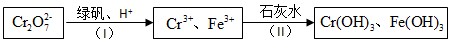题目内容
20.完成下列3道小题,(1)1.5mol CO2的质量是66g,在标准状况下的体积为33.6L,所含氧原子的数目为3NA.
(2)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为1:2,碳原子和氧原子的个数比为3:4,该混合气体的摩尔质量为$\frac{100}{3}$mol/L.
(3)向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
①原混合物中Na2SO4的物质的量浓度;
②在标准状况下产生气体的体积.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$,结合分子的组成分析;
(2)依据n=$\frac{m}{M}$计算物质的量之比,结合物质的量之比和分子式计算碳原子和氧原子物质的量之比即个数比,混合气体平均摩尔质量=$\frac{混合气体质量}{总物质的量}$;
(3)沉淀质量减少到2.33g,并放出气体,则2.33g固体为BaSO4,以此可计算Na2SO4的物质的量,同时生成BaCO3沉淀,质量为6.27g-2.33g=3.94g,以此可计算Na2CO3的物质的量,并计算气体的体积.
解答 解:(1)1.5mol CO2的质量是m=nM=1.5mol×44g/mol=66g;在标准状况下体积为1.5mol×22.4L/mol=33.6L;所含O原子数为1.5NA×2=3NA;
故答案为:66g;33.6L;3NA;
(2)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比=$\frac{11}{44}$:$\frac{14}{28}$=1:2,碳原子和氧原子的个数比=(1+2):(2+2)=3:4;该混合气体的摩尔质量=$\frac{44×1+28×2}{1+2}$=$\frac{100}{3}$mol/L;
故答案为:1:2;3:4;$\frac{100}{3}$mol/L;
(3)①设Na2SO4的物质的量为x,
BaCl2+Na2SO4=BaSO4↓+2NaCl
1mol 233g
x 2.33g
x=0.01mol,
c(Na2SO4)=$\frac{0.01mol}{0.01L}$=1mol/L,
答:原混合物中Na2SO4的物质的量浓度为1mol/L,
②设产生的气体的体积为V,
BaCO3+2HCl=BaCl2+H2O+CO2↑
197g 22.4L
6.27g-2.33g=3.94g V
V=0.448L,
答:在标准状况下产生气体的体积为0.448L.
点评 本题考查了物质的量的有关计算、有关方程式的计算,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案(一)制备苯乙烯(原理如反应I所示):
I.
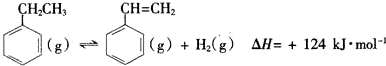
(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
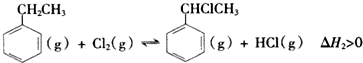
(二)制备α-氯乙基苯(原理如反应II所示):
II.
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
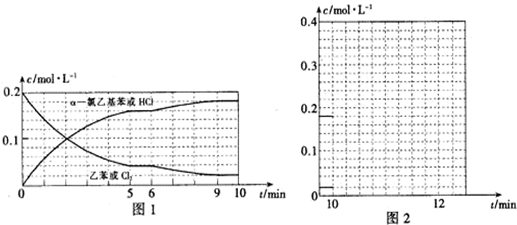
①0-5min内,以HCl表示的该反应速率v(HCl)=0.032 mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
| A. | 熔融NaHSO4电离出的阳离子与阴离子之比 | |
| B. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中c(OH-)之比 |
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
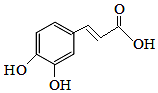
| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
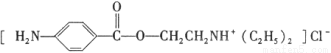 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: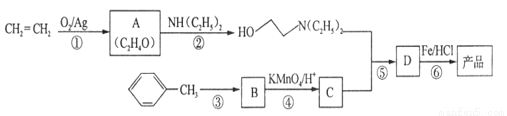

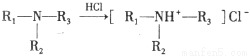
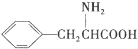 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O;
+3H2O;