题目内容
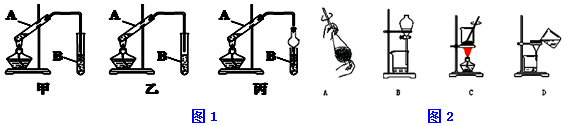
1. (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图①图中的错误是没用玻璃棒引流.除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:烧杯、玻璃棒、胶头滴管.
②根据计算得知,所需NaOH的质量为2.0g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解并冷却后的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处.
(2)出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第E步观察液面时俯视偏高;
B.没有进行操作步骤 C 中的冷却偏高;
C.在第A步不慎有少量液体流到容量瓶外偏低.
(3)今欲用18mol/L的浓硫酸配制480mL1.0mol/L的稀硫酸溶液.
a.配制过程中应当使用500mL的容量瓶.
b.需要量取27.8mL的浓硫酸.
c.选用50mL的量筒(10mL、25mL、50mL、100mL)
分析 (1)①移液时应用玻璃棒引流;依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
②依据m=CVM计算需要溶质的质量;
③依据配制一定物质的量浓度溶液一般步骤排序;
(2)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)a.依据配制溶液体积选择容量瓶规格;
b.依据溶液稀释过程中溶质的物质的量不变计算浓硫酸体积;
c.依据浓硫酸体积选择合适规格量筒.
解答 解:(1)①移液时应用玻璃棒引流;配制一定物质的量浓度溶液一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平(量筒)、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,还需要的仪器:烧杯、玻璃棒、胶头滴管;
故答案为:没用玻璃棒引流;烧杯、玻璃棒、胶头滴管;
②配制0.1mol/LNaOH溶液500mL,需要溶质的质量m=0.1mol/L×0.5L×40g/mol=2.0g;
故答案为:2.0;
③配制一定物质的量浓度溶液一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,所以正确的顺序为:BCAFED;
故答案为:BCAFED;
(2)A.某同学在第E步观察液面时俯视,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
B.没有进行操作步骤 C 中的冷却,冷却后溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
C.在第A步不慎有少量液体流到容量瓶外,导致溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
(3)a.配制480mL1.0mol/L的稀硫酸溶液,应选择500mL容量瓶;
故答案为:500;
b.设需要浓硫酸体积为V,依据溶液稀释过程中溶质的物质的量不变得:V×18mol/L=500mL×1.0mol/L,解得V=27.8mL;
故答案为:27.8;
c.量取25.8mL浓硫酸应选择50mL规格量筒;
故答案为:50.
点评 本题考查了一定物质的量浓度溶液配制,明确配制原理及操作步骤是解题关键,注意容量瓶构造及使用方法、注意事项,题目难度不大.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案(一)制备苯乙烯(原理如反应I所示):
I.
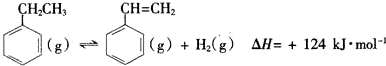
(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.
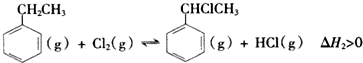
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
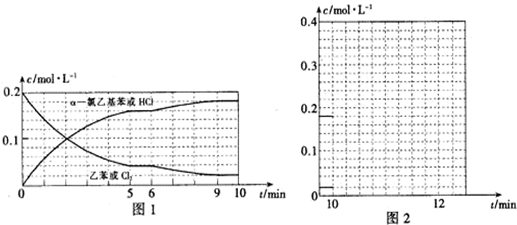
①0-5min内,以HCl表示的该反应速率v(HCl)=0.032 mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
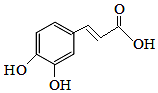
| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O;
+3H2O;  或
或 .
.