题目内容
8.回答下列问题:(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是SO2+SO32-+H2O=2HSO3-.常温下,Na2SO3溶液的pH>7.原因是SO32-+H2O?HSO3-+OH-(用离子方程式表示).
(2)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.某温度下该反应的平衡常数K=$\frac{10}{3}$.
①该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)< v(逆)(填“<”、“>”或“=”).
②该温度下,向一体积为2L的恒容密闭容器中充入2.0mol SO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为60%.
分析 (1)Na2SO3溶液吸收SO2气体生成NaHSO3;常温下SO32-水解使得溶液显碱性,且分步水解,据此可写出水解反应离子方程式;
(2)①计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆)相对大小;
②恒温恒压下,压强之比等于物质的量之比,计算平衡时混合气体总物质的量,再利用差量法计算转化的二氧化硫物质的量,进而计算二氧化硫转化率.
解答 解:(1)Na2SO3溶液吸收SO2气体生成NaHSO3,时发生反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;Na2SO3为强碱弱酸盐,SO32-水解使得溶液显碱性,pH>7,且分步水解,水解反应离子方程式为SO32-+H2O?HSO3-+OH-;
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O?HSO3-+OH-;
(2)①此时浓度商Qc=$\frac{0.0{3}^{2}}{0.0{3}^{2}×0.06}$=$\frac{50}{3}$>K=$\frac{10}{3}$,反应向逆反应进行,则v(正)<v(逆),
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×$\frac{1.6L}{2L}$=2.4mol,则:
2SO2(g)+O2(g)?2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为$\frac{1.2mol}{2mol}$×100%=60%,
故答案为:60%.
点评 本题考查盐类的水解、化学平衡计算与影响因素、平衡常数应用、电化学原理及有关计算等,(3)中C选项为易错点,学生容易考虑平衡移动,忽略体积变化,(5)中注意加入的水部分参加反应,利用总反应式进行计算,难度中等.

| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是ab;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是因为该反应为吸热反应,温度越高,反应速率加快,平衡右移.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据该反应是焓增,熵减的反应,任何温度下均不自发进行.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
C2H2(g)+H2(g)?C2H4(g) ①
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g);△H=-Q1 kJ/mol
C(s)+$\frac{1}{2}$H2(g)=$\frac{1}{2}$C2H2(g);△H=-Q2 kJ/mol
C(s)+H2(g)=$\frac{1}{2}$C2H4(g);△H=-Q3 kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
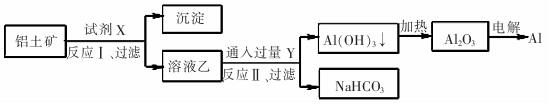
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
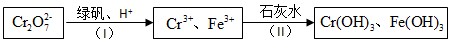


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.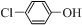 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.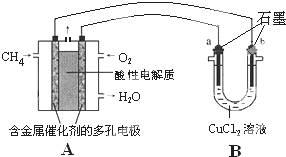 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.