题目内容
2.下列离子方程式正确的是( )| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.氯原子在碱性条件下发生取代反应生成醇羟基;
C.乙醛在水浴加热条件下与银氨溶液发生银镜反应;
D.二氧化碳少量,反应生成苯酚和碳酸氢根离子.
解答 解:A.醋酸和碳酸钙不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故A错误;
B.氯乙酸与足量氢氧化钠溶液共热,反应生成CH2OHCOO-,正确的反应为:CH2ClCOOH+2OH-→CH2OHCOO-+H2O+Cl-,故B错误;
C.用银氨溶液检验乙醛中的醛基,反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故C正确;
D.苯酚的酸性大于碳酸氢根离子,反应生成的是碳酸氢根离子,正确的离子方程式为:苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
12.咖啡酸可用作化学原料的中间体,其结构如图.下列关于咖啡酸的说法中不正确的是( )
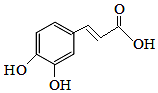

| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
13.若氖原子质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
17.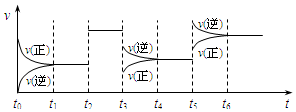 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
( )
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
11.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,氧化性最强的单质是F2
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
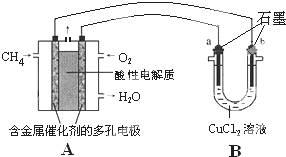 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.