题目内容
某化学兴趣小组研究金属钾的性质,下面是他们研究过程中的一个片段.
【观察】固态金属钾沉在煤油底部,取出用小刀切开后,断面呈银白色但很快变暗.
【预测】钾与钠都是金属单质,化学性质应具有相似性;由钾与钠的原子结构示意图分析,金属钾与金属钠的化学性质应非常相似,可以与O2、H2O等反应.
【实验1】将一小粒金属钾放入盛有水(滴有酚酞)烧杯中,现象与金属钠非常相似,常常发生爆炸.
【实验2】将一小粒金属钾放在石棉网上加热,金属钾剧烈燃烧(比金属钠更快更剧烈),发出紫色火焰,生成黄色固体.根据上述题给信息他们得出下列结论:
(1)金属钾的物理性质有:①银白色固体 ②硬度:比铁的密度小
③熔点: ④密度:
(2)金属钾与水反应的化学方程式
(3)金属钾与金属钠相比,化学性质更活泼吗? (填“是”或“否”),你如何解释
(4)该化学兴趣小组研究的程序是
用了哪些研究方法
(5)该化学兴趣小组原认为金属钾燃烧生成的黄色固体为K2O2,但定量实验表明3.9g K在O2中完全燃烧得到7.1g黄色固体,则该固体的化学式为 ,写出该黄色固体与水反应的化学方程式 .
【观察】固态金属钾沉在煤油底部,取出用小刀切开后,断面呈银白色但很快变暗.
【预测】钾与钠都是金属单质,化学性质应具有相似性;由钾与钠的原子结构示意图分析,金属钾与金属钠的化学性质应非常相似,可以与O2、H2O等反应.
【实验1】将一小粒金属钾放入盛有水(滴有酚酞)烧杯中,现象与金属钠非常相似,常常发生爆炸.
【实验2】将一小粒金属钾放在石棉网上加热,金属钾剧烈燃烧(比金属钠更快更剧烈),发出紫色火焰,生成黄色固体.根据上述题给信息他们得出下列结论:
(1)金属钾的物理性质有:①银白色固体 ②硬度:比铁的密度小
③熔点:
(2)金属钾与水反应的化学方程式
(3)金属钾与金属钠相比,化学性质更活泼吗?
(4)该化学兴趣小组研究的程序是
用了哪些研究方法
(5)该化学兴趣小组原认为金属钾燃烧生成的黄色固体为K2O2,但定量实验表明3.9g K在O2中完全燃烧得到7.1g黄色固体,则该固体的化学式为
考点:碱金属及其化合物的性质实验
专题:几种重要的金属及其化合物
分析:(1)类比钠的物理性质回答即可;
(2)依据钠与水的反应写出即可;
(3)依据钠与水反应常常发生爆炸判断活泼性即可;
(4)依据研究程序以及方法回答即可;
(5)依据元素守恒判断即可.
(2)依据钠与水的反应写出即可;
(3)依据钠与水反应常常发生爆炸判断活泼性即可;
(4)依据研究程序以及方法回答即可;
(5)依据元素守恒判断即可.
解答:
解:(1)钠与水反应的现象钠浮在水面上,熔化成闪亮的小球,钾与钠的反应现象类似,故钾的熔点较低,密度较水的要小,故答案为:熔点低;密度小;
(2)钠与水反应生成氢氧化钠与氢气,故钾与水反应生成氢氧化钾与氢气,方程式为:2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑;
(3)金属钾与金属钠相比,据反应的现象金属钾与水反应常常发生爆炸判断,原因是:钾与钠的最外层都只有一个电子,很容易失去,但是金属钾的电子层数比钠多1,故失去电子能力更强;故答案为:是;最外层电子数一样,但是层数比钠多一层,失去电子能力更强;
(4)该化学兴趣小组研究的程序是:观察、推测、实验、类比、结论,用到了类比方法;故答案为:观察、推测、实验、类比、结论;类比;(5)3.9g K的物质的量为0.1mol,7.1g-3.9g=3.2g,3.2g氧原子的物质的量为:0.2mol,故化学式为KO2,与水反应方程式为:4KO2+2H2O=4KOH+3O2↑,
故答案为:KO2;4KO2+2H2O=4KOH+3O2↑.
(2)钠与水反应生成氢氧化钠与氢气,故钾与水反应生成氢氧化钾与氢气,方程式为:2K+2H2O=2KOH+H2↑,故答案为:2K+2H2O=2KOH+H2↑;
(3)金属钾与金属钠相比,据反应的现象金属钾与水反应常常发生爆炸判断,原因是:钾与钠的最外层都只有一个电子,很容易失去,但是金属钾的电子层数比钠多1,故失去电子能力更强;故答案为:是;最外层电子数一样,但是层数比钠多一层,失去电子能力更强;
(4)该化学兴趣小组研究的程序是:观察、推测、实验、类比、结论,用到了类比方法;故答案为:观察、推测、实验、类比、结论;类比;(5)3.9g K的物质的量为0.1mol,7.1g-3.9g=3.2g,3.2g氧原子的物质的量为:0.2mol,故化学式为KO2,与水反应方程式为:4KO2+2H2O=4KOH+3O2↑,
故答案为:KO2;4KO2+2H2O=4KOH+3O2↑.
点评:本题主要考查的是碱金属K的化学性质实验,采用类比的方法进行,属于较好的一道题目.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液呈中性Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| D、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
可逆反应2A(g)+3B(g)?2C(g);△H=-QkJ?mol-1(Q>0).现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入2molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知2Q1=Q2.下列叙述正确的( )
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol?L-1的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现.若用过量的CO在高温下还原原混合物,固体质量减少为( )
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
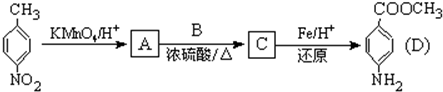
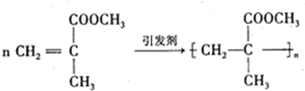
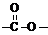 结构的基团的C的所有同分异构体的结构简式:
结构的基团的C的所有同分异构体的结构简式: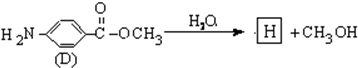
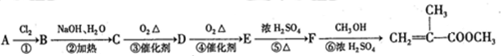 ,
,
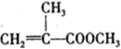 是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是
是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是 、④
、④

 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:
牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究: