题目内容
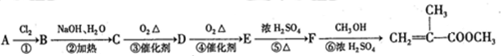
根据盖斯定律判断如图所示的物质转变过程中,△H1、△H2、△H3、△H4的正确关系是( )

| A、△H1=△H2=△H3=△H4 |
| B、△H1-△H2-△H3=△H4 |
| C、△H1-△H3=△H2-△H4 |
| D、△H1>△H2>△H3>△H4 |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:利用盖斯定律解决本类习题时,注意反应的方向,A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,据此分析即可.
解答:
解:A、A→B、B→C、C→D、A→D四个反应的△H不可能相同,故A错误;
B、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,所以△H1-△H2-△H3=△H4,故B正确;
C、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,故C错误;
D、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,△H1所以最大,但△H2,△H3,△H4,无法比较,故D错误;
故选B.
B、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,所以△H1-△H2-△H3=△H4,故B正确;
C、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,故C错误;
D、从反应方向和盖斯定律可知A→D的△H就是A→B→C→D的△H的和,即△H1=△H2+△H3+△H4,△H1所以最大,但△H2,△H3,△H4,无法比较,故D错误;
故选B.
点评:本题是对盖斯定律的深层次理解,注意反应方向即可.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验中配制1mol?L-1的稀硫酸标准,然后用其滴定某未知浓度的氢氧化钠溶液.下列有关说法中正确的是( )
| A、实验中所用到的锥形瓶和容量瓶,在洗涤后均需要润洗 |
| B、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,最终氢氧化钠溶液浓度将偏大 |
| C、滴定时,左手提酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视滴定管内液面变化 |
| D、中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
分离下列各组固体混合物时,可按溶解、过滤、蒸发的操作顺序进行的是( )
| A、氯化钠和硝酸钾 |
| B、铁粉和锌粉 |
| C、氯化钾和碳酸钙 |
| D、碳酸铵和氯化铵 |
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol?L-1的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现.若用过量的CO在高温下还原原混合物,固体质量减少为( )
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
 以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O
以铬酸钾((K2CrO4))为原料,用电化学法制备铬酸钾(K2CrO4)的实验装置如图,其反应原理可表示为4Kr2CrO4+4H2O| 通电 |
| A、在阴极室,随着反应的进行溶液的pH逐渐变小 |
| B、不锈钢电极上生成O2,惰性电极上得到H2 |
| C、惰性电极发生的电极反应为2H2O-4e-═4H++O2↑ |
| D、不锈钢应连接直流电源的正极 |
用价层电子对互斥理论(VSEPR)可以预测许分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
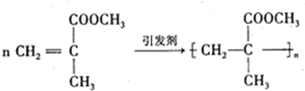
 ,
,
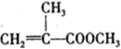 是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是
是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是 、④
、④
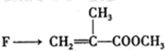
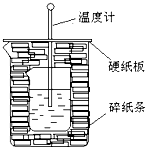 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: