题目内容
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
考点:阿伏加德罗常数
专题:
分析:A、1mol铁与盐酸反应生成的是亚铁离子失去2mol电子;
B、根据乙烯和环丁烷的最简式均为CH2来分析;
C、Fe3+是弱碱阳离子,在水溶液中会水解;
D、根据氧气和臭氧中氧原子的质量计算出氧原子的物质的量及数目;
B、根据乙烯和环丁烷的最简式均为CH2来分析;
C、Fe3+是弱碱阳离子,在水溶液中会水解;
D、根据氧气和臭氧中氧原子的质量计算出氧原子的物质的量及数目;
解答:
解:A、1mol铁与足量盐酸反应失去2mol电子,转移的电子数目为2NA,故A错误;
B、乙烯和环丁烷的最简式相同为CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA,故B正确;
C、Fe3+是弱碱阳离子,在水溶液中会水解,故100mL 1mol/L FeCl3溶液中含有Fe3+小于0.1NA,故C错误;
D、32g氧气和臭氧均由氧原子构成,均含有32g氧原子,含有2mol氧原子,所含有的氧原子数均为2NA,故D错误;
故选B.
B、乙烯和环丁烷的最简式相同为CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA,故B正确;
C、Fe3+是弱碱阳离子,在水溶液中会水解,故100mL 1mol/L FeCl3溶液中含有Fe3+小于0.1NA,故C错误;
D、32g氧气和臭氧均由氧原子构成,均含有32g氧原子,含有2mol氧原子,所含有的氧原子数均为2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
下列物质混合后溶液中溶质的质量分数最大的是( )
| A、4.6g钠投入45.4g水中 |
| B、6.2g氧化钠投入42.2g水中 |
| C、7.8g过氧化钠投入42.2g水中 |
| D、8g烧碱投入42g水中 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
下列各组离子一定能在常温指定环境中大量共存的是( )
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
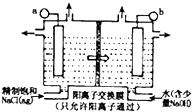 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.