题目内容
在下列反应中,HCl作氧化剂的是(写编号,后同) ,HCl作还原化剂的是
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O.
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)
| ||
D.CuO+2HCl=CuCl2+H2O.
考点:氧化还原反应
专题:
分析:HCl作氧化剂,则H元素的化合价降低,而HCl作还原剂,则Cl元素的化合价升高,以此来解答.
解答:
解:A.NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,不发生氧化还原反应;
B.Zn+2HCl=ZnCl2+H2↑中,H元素的化合价降低,则HCl作氧化剂;
C.MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑中,Cl元素的化合价升高,则HCl为还原剂;
D.CuO+2HCl=CuCl2+H2O中,没有元素的化合价变化,不发生氧化还原反应,
故答案为:B;C.
B.Zn+2HCl=ZnCl2+H2↑中,H元素的化合价降低,则HCl作氧化剂;
C.MnO2+4HCl(浓)
| ||
D.CuO+2HCl=CuCl2+H2O中,没有元素的化合价变化,不发生氧化还原反应,
故答案为:B;C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重氧化剂、还原剂的考查,题目难度不大.

练习册系列答案
相关题目
 柠檬烯是一种食用香料,其结构简式如图.有关柠檬烯的分析正确的是( )
柠檬烯是一种食用香料,其结构简式如图.有关柠檬烯的分析正确的是( )| A、它的一氯代物有6种 |
| B、它的分子中所有的碳原子一定在同一平面上 |
C、它和丁基苯( )互为同分异构体 )互为同分异构体 |
| D、一定条件下,它分别可以发生加成、氧化等反应 |
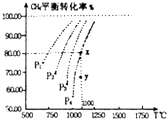 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
下列各说法中,正确的是( )
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
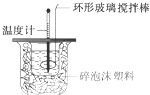 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.