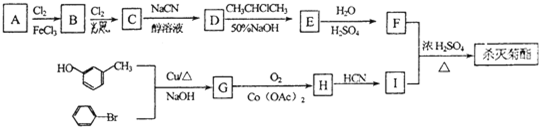
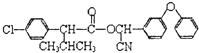
题目内容
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且w、x的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为 .
(2)W、X的最高价氧化物的水化物相互反应的离子方程为 .
(3)工业上制取X单质的化学方程式为 .
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐的化学方程式为 .在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,写出有关反应的化学方程式 ;若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 .
(5)说出Z单质的一种用途 .
(1)X的原子结构示意图为
(2)W、X的最高价氧化物的水化物相互反应的离子方程为
(3)工业上制取X单质的化学方程式为
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐的化学方程式为
(5)说出Z单质的一种用途
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是原子序数依次增大的同一短周期元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N,据此解答.
解答:
解:W、X、Y、Z是原子序数依次增大的同一短周期元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N,
(1)X为Al,原子核外有13的电子,其原子结构示意图为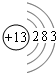 ,故答案为:
,故答案为: ;
;
(2)W、X的最高价氧化物的水化物分别为NaOH、Al(OH)3,反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)工业上电解熔融的氧化铝制取Al单质,化学方程式为2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑;
(4)G的气态氢化物为NH3,Y的最高价氧化物的水化物为H2SO4,二者恰好反应生成的正盐为(NH4)2SO4,化学方程式为2NH3+H2SO4=(NH4)2SO4,在催化剂作用下,汽车尾气中的氧化物NO与CO两种气体能相互反应化为无污染、能参与大气循环的两种气体,应生成N2与CO2,化学方程式为2NO+2CO=N2+2CO2,33.6L(已换算成标准状况)一氧化碳参加反应,CO的物质的量=
=1.5mol,C元素化合价由+2升高为+4,故转移的电子数为1.5mol×(4-2)=3NA,
故答案为:2NH3+H2SO4═(NH4)2SO4;2NO+2CO═N2+2CO2;3NA;
(5)Z为氯元素,氯气常用来制盐酸或制漂白粉,故答案为:制盐酸或制漂白粉.
(1)X为Al,原子核外有13的电子,其原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)W、X的最高价氧化物的水化物分别为NaOH、Al(OH)3,反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)工业上电解熔融的氧化铝制取Al单质,化学方程式为2Al2O3(熔融)
| ||
| ||
(4)G的气态氢化物为NH3,Y的最高价氧化物的水化物为H2SO4,二者恰好反应生成的正盐为(NH4)2SO4,化学方程式为2NH3+H2SO4=(NH4)2SO4,在催化剂作用下,汽车尾气中的氧化物NO与CO两种气体能相互反应化为无污染、能参与大气循环的两种气体,应生成N2与CO2,化学方程式为2NO+2CO=N2+2CO2,33.6L(已换算成标准状况)一氧化碳参加反应,CO的物质的量=
| 33.6L |
| 22.4L/mol |
故答案为:2NH3+H2SO4═(NH4)2SO4;2NO+2CO═N2+2CO2;3NA;
(5)Z为氯元素,氯气常用来制盐酸或制漂白粉,故答案为:制盐酸或制漂白粉.
点评:本题考查结构性质位置关系应用,涉及常用化学用语、元素化合物知识、氧化还原反应计算等,难度中等,推断元素是解题关键,答题时注意元素化合物知识的灵活运用.

练习册系列答案
相关题目
下列说法正确的是( )
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
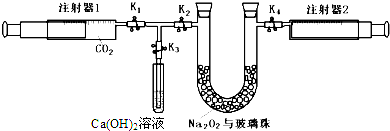
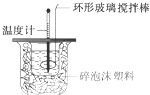 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.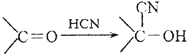
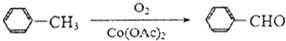
 );
);