题目内容
 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
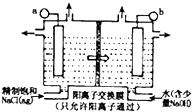
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极ClO2产生的电极方程式:
(2)电解一段时间,当阴极产生标准状况下气体112ml时,停止电解,则通过阳离子交换膜的阳离子物质的量为
(3)ClO2对污水中Fe2+,Mn2+,S2-,CN-等有明显去除效果,某工厂中污水含CN-(a mg/L),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;阳离子移向阴极;
(2)在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子.
(2)在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
| V |
| Vm |
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子.
解答:
解:(1)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
从图上可见,阳离子移向阴极,所以b为阴极,故答案为:Cl--5e-+2H2O=ClO2↑+4H+;阴极;
(2)在阴极发生2H++2e-=H2↑,氢气的物质的量为
=
=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;pH变大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
从图上可见,阳离子移向阴极,所以b为阴极,故答案为:Cl--5e-+2H2O=ClO2↑+4H+;阴极;
(2)在阴极发生2H++2e-=H2↑,氢气的物质的量为
| V |
| Vm |
| 0.112L |
| 22.4L/mol |
故答案为:0.01;pH变大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
点评:本题考查氧化还原反应、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
下列有关有机物的叙述正确的是( )
A、 和 和 互为同系物 互为同系物 |
| B、用系统命名法命名新戊烷为2,2-二甲基丙烷 |
| C、相对分子质量相近的醇和烷烃相比,醇的沸点远远低于烷烃 |
| D、石油化工中的分馏、裂化、裂解都是通过化学变化得到轻质油 |
常温下,有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A、均存在电离平衡与水解平衡 |
| B、c(OH-):①>② |
| C、存在的粒子种类相同 |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
下列说法不正确的是( )
| A、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
| B、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
| C、2012年诺贝尔化学奖授予两位美国科学家罗伯特?莱夫科维茨和布莱恩?克比尔卡,以表彰他们在“G蛋白偶联受体研究”中取得的重大成就 |
| D、道尔顿、李比希、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 |
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
下列变化中,属于放热反应的是( )
| A、H2O(g)═H2O(l)△H=-44kJ/mol |
| B、2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol |
C、 能量变化如图所示的化学反应 |
| D、形成化学键时放出能量的化学反应 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |