题目内容
下列物质混合后溶液中溶质的质量分数最大的是( )
| A、4.6g钠投入45.4g水中 |
| B、6.2g氧化钠投入42.2g水中 |
| C、7.8g过氧化钠投入42.2g水中 |
| D、8g烧碱投入42g水中 |
考点:溶液中溶质的质量分数及相关计算,钠的重要化合物
专题:
分析:先根据反应求出溶质,然后根据溶质质量分数=
×100%计算比较;
| 溶质质量 |
| 溶液质量 |
解答:
解:A、4.6gNa物质的量=
=0.2mol,投入45.4g水中,反应生成氢氧化钠和氢气,溶质质量为0.2mol×40g/mol=8g,生成氢气质量为0.1mol×1g/mol=0.1g,质量分数=
×100%=16.03%;
B、6.2gNa2O物质的量=
=0.1mol,投入42.2g的水中反应生成溶质氢氧化钠物质的量为0.2mol,质量为8g,溶质质量分数为
×100%=16.52%;
C、7.8gNa2O2物质的量=
=0.1mol,投入42.2g的水中生成溶质氢氧化钠质量为0.2mol×40g/mol=8g,生成氧气质量为0.05mol×32g/mol=1.6g,溶质质量分数=
×100%=16.52%;
D、8g烧碱投入42g水中,溶质为NaOH,质量分数=
×100%=16%;
故选BC.
| 4.6g |
| 23g/mol |
| 8g |
| 4.6g+45.4g-0.1g |
B、6.2gNa2O物质的量=
| 6.2g |
| 62g/mol |
| 8g |
| 6.2g+42.2g |
C、7.8gNa2O2物质的量=
| 7.8g |
| 78g/mol |
| 8g |
| 7.8g+42.2g-1.6g |
D、8g烧碱投入42g水中,溶质为NaOH,质量分数=
| 8g |
| 8g+42g |
故选BC.
点评:本题考查了溶液中溶质质量分数的分析计算,依据元素守恒计算溶质、溶液质量,掌握基础是关键,题目较简单.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
利用如图装置(瓶口向上)不可行的实验是( )


| A、A口进气,B口排气,用于收集H2 |
| B、广口瓶充满水,从A中进气用于收集O2 |
| C、广口瓶中盛有浓硫酸,从B口进气用于干燥SO2气体 |
| D、广口瓶盛有NaOH水溶液,从B中进气用于除去Cl2中的HCl气体 |
下列说法正确的是( )
| A、液氨汽化时要吸收大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、氯化铝是一种电解质,可用于电解法制铝 |
常温下,有关①100ml 0.1mol/L NaHCO3、②100ml 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A、均存在电离平衡与水解平衡 |
| B、c(OH-):①>② |
| C、存在的粒子种类相同 |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
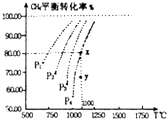 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
下列说法不正确的是( )
| A、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
| B、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
| C、2012年诺贝尔化学奖授予两位美国科学家罗伯特?莱夫科维茨和布莱恩?克比尔卡,以表彰他们在“G蛋白偶联受体研究”中取得的重大成就 |
| D、道尔顿、李比希、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 |
下列哪种燃料直接燃烧对环境污染最严重( )
| A、煤 | B、柴油 | C、天然气 | D、酒精 |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1mol铁与足量盐酸完全反应转移的电子数目为3NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为NA |
| C、100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA |
| D、32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3 |
 );
);