题目内容
测定水中溶解氧气的方法是:取a mol水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子、振荡,使反应充分;开塞,迅速加入适量H2SO4,此时有I2生成;用Na2S2O3溶液(浓度b mol?L-1)和I2反应,消耗了V mL达到终点(以淀粉作指示剂).有关方程式为:①2Mn2++O2+4OH-═2MnO(OH)2(反应很快)
②MnO(OH)2+2I-+4H+═Mn2++I2+3H2O ③I2+2S2O32-═S4O62-+2I-
(1)需要进行滴定的反应是: ,终点的颜色变化为: .
(2)水中溶解O2为(以mg/L为单位): mg/L.
(3)加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将 (填“偏
高”“偏低”或“无影响”),原因是: .
②MnO(OH)2+2I-+4H+═Mn2++I2+3H2O ③I2+2S2O32-═S4O62-+2I-
(1)需要进行滴定的反应是:
(2)水中溶解O2为(以mg/L为单位):
(3)加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将
高”“偏低”或“无影响”),原因是:
考点:中和滴定
专题:实验题
分析:(1)根据题意可知利用Na2S2O3溶液滴定单质碘;I2与S2O32-反应以淀粉为指示剂,在含I2的溶液中加入淀粉后溶液变蓝色,这个过程是可逆的,向溶液中加入Na2S2O3溶液与I2发生反应,当I2刚好被消耗完后,溶液由蓝色变为无色;
(2)根据2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,可利用关系式进行计算;
(3)若塞子未塞紧,水中溶解的O2反应消耗完后,空气中的O2又会溶解.
(2)根据2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,可得关系式:O2~4S2O32-,可利用关系式进行计算;
(3)若塞子未塞紧,水中溶解的O2反应消耗完后,空气中的O2又会溶解.
解答:
解:(1)根据题意可知利用Na2S2O3溶液滴定单质碘,滴定反应为:I2+2S2O32-═S4O62-+2I-,使用淀粉做指示剂,溶液蓝色褪去,且半分钟内不恢复,则为滴定终点,
故答案为:I2+2S2O32-═S4O62-+2I-;溶液蓝色褪去,且半分钟内不恢复;
(2)2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,
可得关系式:O2~4S2O32-,n(S2O32-)=b mol?L-1×V×10-3L=bV×10-3mol,则n(O2)=
×bV×10-3mol,m(O2)=
×bV×10-3mol×32g/mol=8bV×10-3g=8bVmg,则水中的溶解氧量为
=
mg?L-1;
故答案为:
mg?L-1;
(3)若塞子未塞紧,水中溶解的O2反应消耗完后,空气中的O2又会溶解,这样会引起测定结果的偏高,
故答案为:偏高;水中溶解的O2反应消耗完后,空气中的O2又会溶解.
故答案为:I2+2S2O32-═S4O62-+2I-;溶液蓝色褪去,且半分钟内不恢复;
(2)2Mn2++4OH-+O2=2MnO(OH)2; MnO(OH)2+2I-+4H+=I2+Mn2++3H2O;I2+2S2O32-=2I-+S4O62-,
可得关系式:O2~4S2O32-,n(S2O32-)=b mol?L-1×V×10-3L=bV×10-3mol,则n(O2)=
| 1 |
| 4 |
| 1 |
| 4 |
| 8bV | ||
|
| 8000bV |
| a |
故答案为:
| 8000bV |
| a |
(3)若塞子未塞紧,水中溶解的O2反应消耗完后,空气中的O2又会溶解,这样会引起测定结果的偏高,
故答案为:偏高;水中溶解的O2反应消耗完后,空气中的O2又会溶解.
点评:本题考查了水样中氧气含量的测定,涉及的内容较多,难度较大,需要分析实验原理并联系滴定知识合理完成,充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
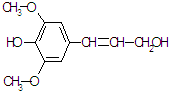 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )| A、芥子醇的分子式是C11H16O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、芥子醇能与3mol溴水反应 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
下列反应中生成物总能量高于反应物总能量的是( )
| A、氯酸钾受热分解 |
| B、乙醇燃烧 |
| C、铝粉与氧化铁粉末发生铝热反应 |
| D、盐酸与氢氧化钠溶液混合 |
化合物丙可由如下反应得到: ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A、CH3CH(CH2Br)2 |
| B、(CH3)2CBrCH2Br |
| C、C2H5CHBrCH2Br |
| D、CH3(CHBr)2CH3 |
在容积相等的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol和b mol HI(a>b),发生反应2HI(g)?H2(g)+I2(g)达到平衡后,下列说法中,正确的是( )
| A、从开始反应到达平衡,所需时间tA>tB |
| B、平衡时,I2蒸气在混合气体中的体积分数φA>φB |
| C、平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B |
| D、HI的平衡转化率,αA=αB |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.