题目内容
饮用水质量是关系人类健康的问题.
(1)氯气是最早用于饮用水消毒的物质,写出其有消毒作用的主要反应的离子方程式为 ;
(2)写出工业上制取漂白粉的化学方程式: ;
(3)ClO2被称为第四代饮用水消毒剂,我国北京永利科技有限公司已用电解法批量生产ClO2.其反应原理为
4ClO3-+4H+═4ClO2↑十O2↑十2H2O.试写出两电极反应式阳极 ;阴极 ;
(4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是 ;
(5)采用氧气的一种同素异形体给自来水消毒,既提高了消毒率、安全无副作用,又因为该物质在自然界中存在,对地球生命体起保护伞作用.该物质和氯气溶于水以及SO2的漂白原理分别是 ; .若将氯气与SO2二者混合,若想使石蕊试液褪色,则
范围为 .
(1)氯气是最早用于饮用水消毒的物质,写出其有消毒作用的主要反应的离子方程式为
(2)写出工业上制取漂白粉的化学方程式:
(3)ClO2被称为第四代饮用水消毒剂,我国北京永利科技有限公司已用电解法批量生产ClO2.其反应原理为
4ClO3-+4H+═4ClO2↑十O2↑十2H2O.试写出两电极反应式阳极
(4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是
(5)采用氧气的一种同素异形体给自来水消毒,既提高了消毒率、安全无副作用,又因为该物质在自然界中存在,对地球生命体起保护伞作用.该物质和氯气溶于水以及SO2的漂白原理分别是
| n(Cl2) |
| n(SO2) |
考点:氯气的化学性质,氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)氯气与水反应生成HCl、HClO,HClO具有消毒作用;
(2)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水;
(3)阳极发生氧化反应,阴极发生还原反应;
(4)氯气中氯由0价变成-1价,二氧化氯中的氯由+4变-1价,所以相同物质的量转移电子之比为:2:5;
(5)二氧化硫具漂白性,可使有机色质褪色(SO2能使品红溶液褪色),但是二氧化硫不能使指示剂褪色;若将二者等物质的量混合,通入紫色石蕊试液,那么溶液变红,不会褪色,因为:Cl2+SO2+H2O=2HCl+H2SO4.
(2)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水;
(3)阳极发生氧化反应,阴极发生还原反应;
(4)氯气中氯由0价变成-1价,二氧化氯中的氯由+4变-1价,所以相同物质的量转移电子之比为:2:5;
(5)二氧化硫具漂白性,可使有机色质褪色(SO2能使品红溶液褪色),但是二氧化硫不能使指示剂褪色;若将二者等物质的量混合,通入紫色石蕊试液,那么溶液变红,不会褪色,因为:Cl2+SO2+H2O=2HCl+H2SO4.
解答:
解:(1)氯气溶于水后生成了次氯酸和盐酸,氯气、水、次氯酸在离子反应中保留化学式,则离子反应为Cl2+H2O═H++Cl-+HClO,
故答案为:Cl2+H2O═H++Cl-+HClO;
(2)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
(3)4ClO3-+4H+=4ClO2↑+O2↑+2H2O的反应中:阳极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为:8H++4ClO3-+4e-=4ClO2↑=4H2O,
故答案为:2H2O-4e-=O2↑+4H+;8H++4ClO3-+4e-=4ClO2↑+4H2O;
(4)氯气中氯由0价变成-1价,二氧化氯中的氯由+4变-1价,所以相同物质的量转移电子之比为2:5,故答案为:2:5;
(5)HClO强氧化性漂白,二氧化硫与有色物质化合具漂白性,若将二者等物质的量混合,发生Cl2+SO2+H2O=2HCl+H2SO4,则通入紫色石蕊试液,那么溶液变红,所以氯气过量,即n(Cl2):n(SO2)>1,故答案为:HClO强氧化性漂白;二氧化硫与有色物质化合具漂白性;>1.
故答案为:Cl2+H2O═H++Cl-+HClO;
(2)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
(3)4ClO3-+4H+=4ClO2↑+O2↑+2H2O的反应中:阳极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为:8H++4ClO3-+4e-=4ClO2↑=4H2O,
故答案为:2H2O-4e-=O2↑+4H+;8H++4ClO3-+4e-=4ClO2↑+4H2O;
(4)氯气中氯由0价变成-1价,二氧化氯中的氯由+4变-1价,所以相同物质的量转移电子之比为2:5,故答案为:2:5;
(5)HClO强氧化性漂白,二氧化硫与有色物质化合具漂白性,若将二者等物质的量混合,发生Cl2+SO2+H2O=2HCl+H2SO4,则通入紫色石蕊试液,那么溶液变红,所以氯气过量,即n(Cl2):n(SO2)>1,故答案为:HClO强氧化性漂白;二氧化硫与有色物质化合具漂白性;>1.
点评:本题考查氯气的性质,为高频考点,把握发生的反应及电极反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
己烯雌酚是一种激素类药物,结构如图,下列有关它的叙述中错误的是( )


| A、己烯雌酚可以用有机溶剂萃取 |
| B、己烯雌酚与NaOH溶液和NaHCO3溶液都能反应 |
| C、1 mol己烯雌酚与溴水反应,可消耗5 mol Br2 |
| D、己烯雌酚分子中最多有16个碳原子共平面 |
下列说法正确的是( )
| A、甲烷的燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、NaOH(aq)+CH3COOH (aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol (中和热) |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、2H2 (g)+O2(g)=2H2O(l)△H=-571.6kJ/mol (燃烧热) |
下列物质属于纯净物的是( )
| A、漂白粉 | B、盐酸 | C、氯水 | D、液溴 |
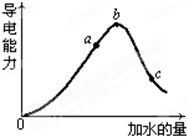 (1)a、b、c三点中醋酸的电离程度最大的是
(1)a、b、c三点中醋酸的电离程度最大的是

 +H2O(R1、R2、R3为烃基或氢原子)
+H2O(R1、R2、R3为烃基或氢原子) 中含有酚羟基所用的试剂是
中含有酚羟基所用的试剂是