题目内容
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA | |
| C. | 完全燃烧1.5 molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1 L 0.1mol L-1的Na2S溶液中S2-和HS-的总数为0.1NA |
分析 A.氮气与氢气反应生成氨气为可逆反应;
B.NO2和N2O4最简式为NO2;
C.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O?HS-+OH-;HS-+H2O?H2S+OH-.
解答 解:A.氮气与氢气反应生成氨气为可逆反应,可逆反应不能朝着一个方向进行到底,1molN2和3molH2充分反应,生成的氨气小于2mol,生成N-H键数目小于6NA,故A错误;
B.NO2和N2O4最简式为NO2,故9.2g混合物中含有的NO2的物质的量为n=$\frac{9.2g}{46g/mol}$=0.2mol,故含0.4mol氧原子即0.4NA个,故B错误;
C.1molCH3CH2OH、C2H4完全燃烧消耗氧气都是3mol,转移电子数都是4×3NA,所以完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA,故C正确;
D.硫离子为多元弱酸根离子存在两步水解:S2-+H2O?HS-+OH-;HS-+H2O?H2S+OH-,依据物料守恒可知:1L 0.1 mol/L的Na2S溶液中S2-和HS-、H2S,总数为0.1NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,侧重考查可逆反应、电子转移的计算、微粒个数的计算,明确可逆反应特点、熟悉盐溶液中存在的物料守恒是解题关键,题目难度中等.

练习册系列答案
相关题目
5.A、B、C为三种短周期元素,A,B同周期,A、C的最低价离子分别为A2-、C-、B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
| A. | 离子半径A2->C->B2+ | B. | 它们的原子半径C>B>A | ||
| C. | 它们的原子序数A>B>C | D. | 原子最外层上的电子数C>A>B |
15.下列每组物质中含有的化学键类型相同的是( )
| A. | NaCl、HCl、H2O、NaOH | B. | Cl2、Na2S、HCl、CO2 | ||
| C. | HBr、CCl4、H2O、CO2 | D. | Na2O2、H2O2、H2O、O2 |
12.用NA表示阿伏加德岁常数的值下列说法止确的是( )
| A. | 标准状况下,22.4L H20中含有的分子数为NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05NA | |
| C. | 7.lgCl2 与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA | |
| D. | 1L lmol/L CaCl2溶液中含有的氯离子数为NA |
16.下列有关叙述正确的是( )
| A. | 在反应BrCl+H2O═HCl+HBrO中,BrCl既是氧化剂又是还原剂 | |
| B. | 双氧水与高锰酸钾酸性溶液反应:2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | K37ClO3与H35Cl反应的化学方程式为K37ClO3+6H35Cl═K37Cl+335Cl2↑+3H2O | |
| D. | 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移4NA个电子(NA为阿伏伽德罗常数的值) |
17.将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 生成的乙酸乙酯中含有18O | |
| B. | 能生成乙酸乙酯的质量为88g | |
| C. | 生成乙酸乙酯的质量为90g | |
| D. | 反应后的混合物中有两种物质含18O |
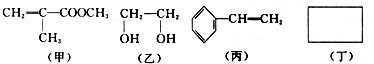
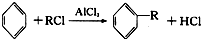 (-R为烃基)
(-R为烃基)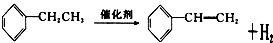
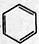 +CH3CH2Cl
+CH3CH2Cl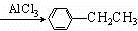 +HCl.
+HCl.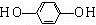 .
. .
.
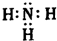 .化合物X的电子式
.化合物X的电子式 .
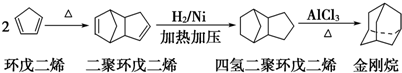
.
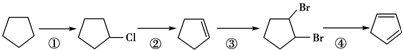
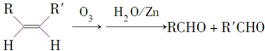 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: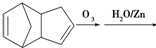
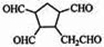 .
.