题目内容
16.下列有关叙述正确的是( )| A. | 在反应BrCl+H2O═HCl+HBrO中,BrCl既是氧化剂又是还原剂 | |
| B. | 双氧水与高锰酸钾酸性溶液反应:2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | K37ClO3与H35Cl反应的化学方程式为K37ClO3+6H35Cl═K37Cl+335Cl2↑+3H2O | |
| D. | 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移4NA个电子(NA为阿伏伽德罗常数的值) |
分析 A、在BrCl+H2O═HCl+HBrO反应中,元素化合价都没有发生变化;
B、酸性高锰酸钾溶液与H2O2反应,H2O2是还原剂被氧化,-1价氧元素的化合价全部升高;
C、K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O,35Cl中Cl元素的化合价由+5价降低为0,37Cl中Cl元素的化合价由-1价升高为0,以此来解答;
D、CH3CH2OH中的碳元素的化合价为:-2,而CH3COOH中的碳元素的化合价为:0,所以每消耗1mol乙醇转移2×2=4mol的电子.
解答 解:A、在BrCl+H2O═HCl+HBrO反应中,元素化合价都没有发生变化,不是氧化还原反应,故A错误;
B、酸性高锰酸钾溶液与H2O2反应,H2O2是还原剂被氧化,-1价氧元素的化合价全部升高,所以反应的方程式为:5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O,故B错误;
C、氯酸钾是氧化剂、部分HCl是还原剂,则被氧化和被还原的氯原子数之比为5:1,所以氯气中的氯质量数不全是35,35的氯和37的氯的原子数之比为5:1,故C错误;
D、CH3CH2OH中的碳元素的化合价为:-2,而CH3COOH中的碳元素的化合价为:0,所以每消耗1mol乙醇转移2×2=4mol的电子,所以转移4NA个电子,故D正确;
故选D.
点评 本题考查氧化还原反应,为基础性试题,为高频考点,注意从化合价的角度解答该题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某无色透明溶液,能与铝作用放氢气,则此溶液中一定可以大量共存的离子组是( )
| A. | K+、Na+、Cl- | B. | K+、Cu2+、SO42- | C. | Cl-、NO3-、Mg2+ | D. | Ba2+、SO42-、Na+ |
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA | |
| C. | 完全燃烧1.5 molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1 L 0.1mol L-1的Na2S溶液中S2-和HS-的总数为0.1NA |
4.下列说法正确的是( )
| A. | CO是酸性氧化物 | B. | BaSO4 是强电解质 | ||
| C. | 氢氧化铁胶体属于纯净物 | D. | 纯碱属于碱类物质 |
1.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,正极反应为:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )
| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
8.下列说法正确的是( )
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可自身或与其他物质发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
5.一定能使化学反应速率加快的因素是( )
①扩大容器容积
②使用正催化剂
③增大反应物的物质的量
④升高温度
⑤缩小容积
⑥增大压强.
①扩大容器容积
②使用正催化剂
③增大反应物的物质的量
④升高温度
⑤缩小容积
⑥增大压强.
| A. | ②③ | B. | ②③④⑥ | C. | ②③③⑤ | D. | ②④ |
6.下列操作能达成实验目的是( )
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用CuSO4溶液除去由电石和饱和食盐水反应生成的乙炔气体中的杂质 | |
| C. | 用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 | |
| D. | 将溴乙烷与氢氧化钠的醇溶液共热后产生的气体通入酸性高锰酸钾溶液以检验乙烯的生成 |
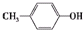 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦
;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦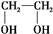 ;⑧CH3CH2OH
;⑧CH3CH2OH