题目内容
25℃时,水的电离达到平衡,下列叙述正确的是( )
| A、向水中加入少量NaOH,平衡逆向移动,新平衡时c(OH-)降低 |
| B、向水中加入少量NH4Cl,平衡正向移动,新平衡时c(OH-)降低 |
| C、pH=5的醋酸和pH=9的氨水中由水电离出的c(OH-)不相等 |
| D、将水加热,Kw增大,pH不变 |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡,水的电离
专题:
分析:A.NaOH在水溶液里完全电离生成OH-导致c(OH-)增大而抑制水电离;
B.NH4Cl中铵根离子和氢离子反应生成弱电解质一水合氨而促进水电离;
C.pH=5的醋酸中水电离出的c(OH-)为10-9 mol/L,pH=9的氨水中水电离出的c(OH-)=10-9 mol/L;
D.水的电离是吸热反应,升高温度促进水电离.
B.NH4Cl中铵根离子和氢离子反应生成弱电解质一水合氨而促进水电离;
C.pH=5的醋酸中水电离出的c(OH-)为10-9 mol/L,pH=9的氨水中水电离出的c(OH-)=10-9 mol/L;
D.水的电离是吸热反应,升高温度促进水电离.
解答:
解:A.NaOH在水溶液里完全电离生成OH-导致c(OH-)增大而抑制水电离,所以平衡逆向移动,达到新的平衡时c(OH-)增大,故A错误;
B.NH4Cl中铵根离子和氢离子反应生成弱电解质一水合氨而促进水电离,导致溶液中c(H+)增大、c(OH-)减小,故B正确;
C.酸或碱都抑制水电离,pH=5的醋酸中水电离出的c(OH-)为10-9 mol/L,pH=9的氨水中水电离出的c(OH-)=10-9 mol/L,所以二者溶液中水电离出的c(OH-)相等,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,导致Kw,c(H+)增大,溶液的pH减小,故D错误;
故选B.
B.NH4Cl中铵根离子和氢离子反应生成弱电解质一水合氨而促进水电离,导致溶液中c(H+)增大、c(OH-)减小,故B正确;
C.酸或碱都抑制水电离,pH=5的醋酸中水电离出的c(OH-)为10-9 mol/L,pH=9的氨水中水电离出的c(OH-)=10-9 mol/L,所以二者溶液中水电离出的c(OH-)相等,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,导致Kw,c(H+)增大,溶液的pH减小,故D错误;
故选B.
点评:本题考查盐类水解、电解质的电离对水电离的影响,酸或碱抑制水电离、含有弱离子的盐促进水电离,难点是计算酸或碱中水电离出的氢离子或氢氧根离子浓度,知道离子积常数只与温度有关,与溶液酸碱性或浓度无关.

练习册系列答案
相关题目
实验室需480mL 1.0mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH中的H+数目 |
| B、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH的电离常数 |
| C、在4NH3+6NO═5N2+6H2O反应中,被氧化和被还原的N原子数 |
| D、纯水在25℃和80℃时的pH |
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、18.4mol/LH2SO4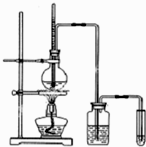 下面是实验室制乙烯并检验其性质的装置图,请回答:
下面是实验室制乙烯并检验其性质的装置图,请回答: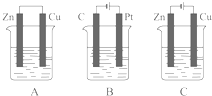 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.