题目内容
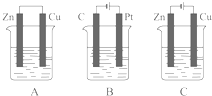 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.(1)A、B、C三个装置中属于原电池的是
(2)A池中Zn是
(3)B池中C棒发生
(4)C池中Zn极的反应现象为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)把电能转化为化学能的装置是电解池,所以电解池有外接电源,原电池是化学能转化为电能;
(2)该装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,锌和氯化铜发生置换反应;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接原电池正极的是阳极,连接原电池负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化.
(2)该装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,锌和氯化铜发生置换反应;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接原电池正极的是阳极,连接原电池负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化.
解答:
解:(1)BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,故选A;
(2)该装置是原电池,较活泼的金属锌作负极,失电子发生还原反应,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu,铜离子浓度减小,故答案为:负;还原;Zn+Cu2+=Zn2++Cu;减小;
(3)B电池中,C连接原电池负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,Cu2++2e-=Cu,阳极上氯离子失电子发生氧化反应,所以电池反应式为:CuCl2
Cl2↑+Cu,故答案为:还原; Cu2++2e-=Cu;CuCl2
Cl2↑+Cu;
(4)铜连接原电池的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变,
故答案为:表面出现红色固体;Cu-2e-=Cu2+;不变.
(2)该装置是原电池,较活泼的金属锌作负极,失电子发生还原反应,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu,铜离子浓度减小,故答案为:负;还原;Zn+Cu2+=Zn2++Cu;减小;
(3)B电池中,C连接原电池负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,Cu2++2e-=Cu,阳极上氯离子失电子发生氧化反应,所以电池反应式为:CuCl2
| ||
| ||
(4)铜连接原电池的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变,
故答案为:表面出现红色固体;Cu-2e-=Cu2+;不变.
点评:本题考查了原电池和电解池原理,易错题是(4),注意活泼金属作电解池阳极时,阳极上电极材料放电而不是溶液中阴离子放电,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,水的电离达到平衡,下列叙述正确的是( )
| A、向水中加入少量NaOH,平衡逆向移动,新平衡时c(OH-)降低 |
| B、向水中加入少量NH4Cl,平衡正向移动,新平衡时c(OH-)降低 |
| C、pH=5的醋酸和pH=9的氨水中由水电离出的c(OH-)不相等 |
| D、将水加热,Kw增大,pH不变 |
糖尿病患者的血液和尿液中含有葡萄糖,含糖量越高,病情越严重,下列方法可以快速测出病人的尿样中是否含有葡萄糖的是( )
| A、用硫酸铜溶液测试 |
| B、用氢氧化钠溶液测试 |
| C、用新制的氢氧化铜悬浊液 |
| D、用PH试纸测试 |
下列物质属于苯的同系物的是( )


| A、①⑥ | B、①②⑤⑥ |
| C、①②⑥ | D、②③④⑤⑥ |
下列说法中正确的是( )
| A、△H的大小与热化学方程式的化学计量数无关 |
| B、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
| C、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| D、破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 |
下列变化中,△S<0的是( )
| A、氯化钠溶于水 |
| B、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| C、干冰(CO2)的升华 |
| D、CaCO3(s)分解为CaO(s)和CO2(g) |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |