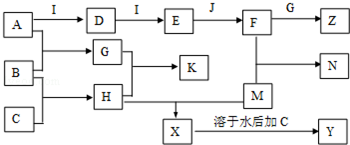
题目内容
20. 电化学原理在医学医疗中有重要应用.
电化学原理在医学医疗中有重要应用.(1)碘可用作心脏起搏器电源-锂碘电池的材料.该电池反应如下:
已知:2Li(s)+I2(s)═2LiI(s)△H
4Li(s)+O2(g)═2Li2O(s)△H1
4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则△H=$\frac{1}{2}$(△H1-△H2)(用含有△H1、△H2的式子表示);碘电极作为该电池的正极.
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示.
请回答下列问题:
①直流电的负极为B (填“A”或“B”);
②阳极电极反应式为2Cl--2e-=Cl2↑,阳极室中接着发生的反应的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③电解结束后,阴极室溶液的pH与电解前相比将不变(填“增大”、“减小”或“不变”);若两极共收集到气体11.2L(标准状况),则除去的尿素为6.0g(忽略气体的溶解).
分析 (1)依据盖斯定律计算反应热,根据碘在反应中化合价降低,反应还原反应来分析;
(2)①电解池的阴极连接电源的负极,根据电解产物判断;
②阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③根据电极方程式计算,有关反应有为阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
解答 解:(1)①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
依据盖斯定律$\frac{(①-②)}{2}$得:2Li(s)+I2(s)═2LiI(s),所以△H=$\frac{1}{2}$(△H1-△H2);碘在反应中化合价降低,反应还原反应,在正极放电,
故答案为:$\frac{1}{2}$(△H1-△H2);正;
(2)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,
故答案为:B;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)
阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的11.2 L气体中,V(N2)=V(CO2)=$\frac{11.2L}{5}$=2.24L,
即n(N2)=n(CO2)=0.1 mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.1 mol N2所消耗的CO(NH2)2的物质的量也为0.1 mol,其质量为:m[CO(NH2)2]=0.1 mol×60 g•mol-1=6.0 g,
故答案为:不变;6.0.
点评 本题考查了盖斯定律及其电解原理知识,包括电极产物的判断、电解原理及其应用等,解答电解原理试题时,首先要注意阳极材料,若阳极材料为除Au、Pt之外的金属,则阳极金属先失去电子,若阳极材料为惰性电极,熟记阴阳离子的放电顺序是解题的关键,题目难度中等.

| A. | 澄清石灰水与稀硝酸反应 | B. | 硫在氧气中燃烧 | ||
| C. | 钠粒与稀盐酸反应 | D. | 碳酸氢钠溶液与氢氧化钠溶液反应 |
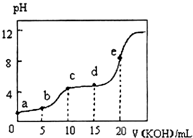 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
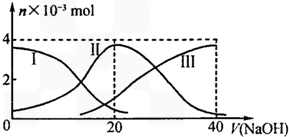 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
| A. | 反应后盐水解使溶液呈碱性 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液反应 |
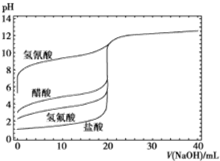 如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸时,应用酚酞做指示剂不能使用甲基橙 | |
| C. | 当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-) | |
| D. | 随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小 |
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
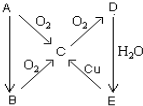 A、B、C、D、E、在一定条件下的转换条件如图所示.
A、B、C、D、E、在一定条件下的转换条件如图所示.