题目内容
12.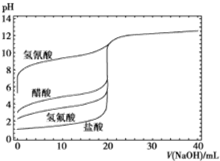 如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸时,应用酚酞做指示剂不能使用甲基橙 | |
| C. | 当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-) | |
| D. | 随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小 |
分析 A.根据滴定前溶液的pH判断;
B.NaOH与醋酸反应生成CH3COONa,溶液显碱性;
C.HCN的酸性小于CH3COOH,相同浓度时,HCN的电离程度小;
D.NaOH与醋酸反应溶液中氢离子浓度减小,对水的抑制程度减小,氢氧化钠过量,NaOH抑制水的电离.
解答 解:A.相同条件下,相同浓度的三种酸,溶液的pH:HF<CH3COOH<HCN,pH越小,酸性越强,所以酸性:HF>CH3COOH>HCN,故A正确;
B.NaOH与醋酸反应生成CH3COONa,溶液显碱性,应该选择在碱性条件下变色的指示剂,所以选择酚酞,故B正确;
C.HCN的酸性小于CH3COOH,相同浓度时,HCN的电离程度小,溶液中CN-的浓度小,所以溶液中c(CN-)<c(CH3COO-),故C错误;
D.随NaOH溶液的滴入,CH3COOH溶液中氢离子浓度减小,对水的抑制程度减小,当氢氧化钠过量,NaOH会抑制水的电离,水的电离程度减小,所以CH3COOH溶液中水的电离程度先变大后变小,故D正确.
故选C.
点评 本题考查了中和滴定曲线,涉及酸性强弱比较、指示剂的选择、盐类的水解和溶液离子浓度的大小比较等知识,注意把握影响水的电离平衡的因素,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.如某地发生氨气泄漏事件,居民们要立即转移,假如你在现场,你会采用以下什么方法?( )
| A. | 向上风口转移 | B. | 向下风口转移 | ||
| C. | 用湿毛巾捂住口鼻 | D. | 及时戴上用硫酸溶液湿润过的口罩 |
7.单斜硫和正交硫是硫的两种同素异形体
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
| A. | △H3=+0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,正交硫比单斜硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
17.选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
4.下列物质中,既能发生消去反应,又能氧化成醛的是( )
| A. |  | B. |  | C. |  | D. |  |
 电化学原理在医学医疗中有重要应用.
电化学原理在医学医疗中有重要应用.