题目内容
10.已知A、B、C、D、E、G、H、I均为气体,J为常见的液态物质,A、B、C、I、M为单质,且M为常见金属,G和H相遇时产生白烟,它们存在如下的转化关系(图中部分反应物或产物已省略),请回答有关问题: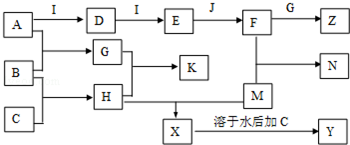
(1)请写出:A物质的化学式:N2,K物质的名称:氯化铵,例举F物质的一种用途制造氮肥、染料塑料、炸药硝酸盐等;
(2)①写出实验室用K制取G的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②实验室检验气体G是否收集满的方法:用湿润的红色石蕊试纸置于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满;
③G在催化剂的作用下与氧气反应,可生成D.请写出该反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)①F的浓溶液与木炭反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20;
②工业F的浓溶液呈黄色,试用化学方程式解释原因:4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O;若要消除黄色可向其中通入一定量的氧气.
分析 A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,根据题中各物质转化关系,A和B反应生成G,B和C反应生成H,G和H相遇时产生白烟,则该反应为氨气与氯化氢的反应,所以K为NH4Cl,B为H2,A能与I连续反应,且E与J反应,J为常见的液态物质,所以I为O2,J为H2O,则A为N2,所以G为NH3,则H为HCl,D为NO,E为NO2,F为HNO3,F和G反应生成Z为NH4NO3,M能与H盐酸反应生成X,X可以继续与C反应,且M为常用金属,则M为Fe,所以X为FeCl2,Y为FeCl3,铁与硝酸反应生成N为Fe(NO3)3,据此答题.
解答 解:A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,根据题中各物质转化关系,A和B反应生成G,B和C反应生成H,G和H相遇时产生白烟,则该反应为氨气与氯化氢的反应,所以K为NH4Cl,B为H2,A能与I连续反应,且E与J反应,J为常见的液态物质,所以I为O2,J为H2O,则A为N2,所以G为NH3,则H为HCl,D为NO,E为NO2,F为HNO3,F和G反应生成Z为NH4NO3,M能与H盐酸反应生成X,X可以继续与C反应,且M为常用金属,则M为Fe,所以X为FeCl2,Y为FeCl3,铁与硝酸反应生成N为Fe(NO3)3,
(1)根据上面的分析可知,A为N2,K为NH4Cl,K的名称为氯化铵,F为HNO3,硝酸常用作制造氮肥、染料塑料、炸药硝酸盐等,
故答案为:N2;氯化铵;制造氮肥、染料塑料、炸药硝酸盐等;
(2)①实验室用氯化铵与氢氧化钙反应制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②实验室检验氨气是否收集满的方法可以用湿润的红色石蕊试纸置于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满,
故答案为:用湿润的红色石蕊试纸置于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满;
③氨气在一定条件下催化氧化也可生成NO,该反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)①浓硝酸与木炭在加热的条件下反应,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20;
②浓硝酸部分分解,溶液中含有少量的二氧化氮,所以溶液呈黄色,其化学方程式为4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,若要消除黄色可向其中通入一定量的氧气,二氧化氮、氧气、水反应生成硝酸,
故答案为:4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O; 氧气.
点评 本题考查无机物的推断,明确物质的颜色及性质是解答本题的关键,注意B、K是解答本题的突破口,并规范化学用语的应用,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在50℃(选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是C(选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3; 装置Ⅳ中的试剂可以是BE.
A.2mol/LNa2CO3溶液 B.品红溶液
C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液 , | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
(精确到0.1%)
(1)已知某反应的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,它所对应反应的化学方程式为C(s)+H2O(g)
 CO(g)+H2(g).
CO(g)+H2(g).(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g)
该反应的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
②该反应的正反应方向是放热反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为75%.
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”).
(3)2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示:
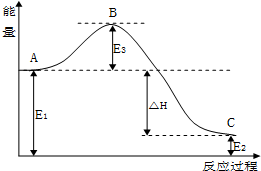
又已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ•mol-1,请回答下列问题:
①图中E1、E2分别表示反应物总能、生成物总能量,E3的大小对该反应的反应热无(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点降低(填“升高”或“降低”)△H不变(填“变大”、“变小”或“不变”),理由是因为催化剂可以降低反应的活化能,但不改变反应热.
②图中△H=-198kJ•mol-1.
| A. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| B. | Na、Mg、Al、Si的还原性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
 电化学原理在医学医疗中有重要应用.
电化学原理在医学医疗中有重要应用.



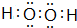 .
.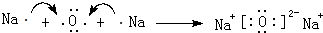 .
.