题目内容
11.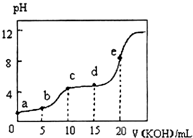 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
分析 A.0.10mol•L-1 H2R(二元弱酸)不能完全电离;
B.c点溶质为KHR,溶液显酸性,HR-的电离程度大于水解程度;
C.e点所示溶液中溶质为K2R,根据质子守恒分析;
D.c点溶质为KHR,则c(HR-)最大.
解答 解:A.0.10mol•L-1 H2R(二元弱酸)不能完全电离,c(H+)<0.1mol/L,则$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012,故A正确;
B.c点为KHR,溶液显酸性,HR-的电离程度大于水解程度,则c(K+)>c(HR-)>c(R2-)>c(H2R),故B错误;
C.e点所示溶液中溶质为K2R,溶液中质子守恒为:c(OH-)=c(HR-)+2c(H2R)+c(H+),故C错误;
D.c点溶质为KHR,HR-的电离程度和水解程度都很小,则c点时c(HR-)最大,故D错误;
故选A.
点评 本题考查酸碱混合溶液的定性判断及离子浓度的关系,明确电荷守恒、物料守恒、质子守恒即可解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
18.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
19.如某地发生氨气泄漏事件,居民们要立即转移,假如你在现场,你会采用以下什么方法?( )
| A. | 向上风口转移 | B. | 向下风口转移 | ||
| C. | 用湿毛巾捂住口鼻 | D. | 及时戴上用硫酸溶液湿润过的口罩 |
 电化学原理在医学医疗中有重要应用.
电化学原理在医学医疗中有重要应用.