题目内容
6.25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为( )| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
分析 根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了72mL及混合气体的体积来列等式计算出乙炔的体积,最后计算乙炔的体积分数.
解答 解:由乙烷、乙炔和丙烯燃烧的方程式可知,除去水蒸气,恢复到原来的温度和压强,
C2H6+$\frac{7}{2}$O2=2CO2+3H2O△V
1 $\frac{7}{2}$ 2 2.5
C2H2+$\frac{5}{2}$O2=2CO2+H2O?△V
1 $\frac{5}{2}$ 2 1.5
C3H6+$\frac{9}{2}$O2=3CO2+3H2O?△V
1 $\frac{9}{2}$ 3 2.5
则C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设C2H6和C3H6一共为xmL,C2H2为ymL,
则有$\left\{\begin{array}{l}{x+y=32}\\{2.5x+1.5y=72}\end{array}\right.$,解得y=8mL,
混合烃中乙炔的体积分数为$\frac{8}{32}×100%=25%$,
故选B.
点评 本题考查学生利用有机物燃烧的化学反应方程式进行体积分数的计算,侧重于学生的分析、计算能力的考查,明确气体体积缩小的量及将乙烷和丙烯看成一种物质是解答的关键,题目难度中等.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 为除去FeCl2溶液中少量的FeCl3,可加入过量铁粉,再过滤 | |
| B. | 明矾中Al3+水解产生具有吸附性的胶体,明矾可用于自来水的净化 | |
| C. | 为除去CO2中少量的HCl,可使其通过饱和的Na2CO3溶液 | |
| D. | 为除去KCl溶液中少量的MgCl2,可加入适量KOH溶液,再过滤 |
10.很多有机反应都会受反应条件的影响,同样的反应物,如果反应条件不同,其生成物可能截然不同,下列各项中不能体现这一观点的是( )
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 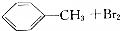 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.下列离子或分子在溶液中能大量共存,加入盐酸后因发生氧化还原反应而不能大量共存的一组是( )
| A. | K+、Na+、SO42-、Cl2 | B. | Ca2+、Na+、Br-、CO32- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Ag+、NH3•H2O、NO3- |
1.二氧化碳与氢气催化合成甲醇,发生的反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
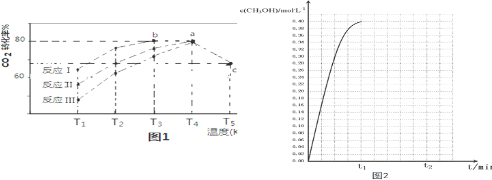
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
①催化剂效果最佳的反应是Ⅰ(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.

15.合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在合成氨工业生产中应采取的适宜条件是( )
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
16.由N2O和NO反应生成N2和NO2的能量变化如图所示.下列说法错误的是( )
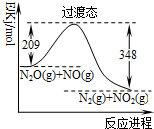

| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |