题目内容
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入50mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下112mL气体.向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为( )| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 1.4g |
分析 Fe、FeO、Fe2O3的混合物中加入盐酸恰好使混合物完全溶解,生成了铁的氯化物,因加入KSCN 溶液,无血红色出现,说明只生成氯化亚铁,根据氯元素守恒可知道氯化亚铁的量,进而求得铁元素的质量,然后结合质量守恒可得出,用足量的CO在高温下还原相同质量的此混合物能得到单质铁的质量.
解答 解:用盐酸溶解后,向所得溶液中加入KSCN溶液无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中,
盐酸的物质的量为:1mol.L-1×0.05L=0.05mol,
根据氯元素守恒,则n(Fe)=n(FeCl2)=$\frac{1}{2}$×n(HCl)=0.025mol,
则混合物中含有Fe元素的质量为:m(Fe)=0.025mol×56g/mol=1.4g,
根据质量守恒可知,用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为1.4g,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.分类是重要的科学研究方法,下列物质分类正确的是( )
| A. | 酸性氧化物:SO2、SiO2、NO2 | B. | 弱电解质:CH3COOH、BaCO3、Fe(OH)3 | ||
| C. | 纯净物:铝热剂、漂粉精、聚乙烯 | D. | 无机物:CaC2、石墨烯、HCN |
5.分类是化学研究的重要方法,下列物质分类错误的是( )
| A. | 化合物:干冰、明矾、烧碱 | B. | 同素异形体:石墨、C60、金刚石 | ||
| C. | 非电解质:乙醇、四氯化碳、氯气 | D. | 混合物:漂白粉、纯净矿泉水、盐酸 |
2.某有机化合物M的结构简式为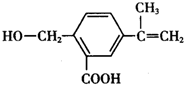 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )
 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )| A. | 有机物M的分子式为C11H14O3 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 有机物M能发生取代、氧化、还原和加聚反应 | |
| D. | 有机物M能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
9.下列说法不正确的是( )
| A. | 为除去FeCl2溶液中少量的FeCl3,可加入过量铁粉,再过滤 | |
| B. | 明矾中Al3+水解产生具有吸附性的胶体,明矾可用于自来水的净化 | |
| C. | 为除去CO2中少量的HCl,可使其通过饱和的Na2CO3溶液 | |
| D. | 为除去KCl溶液中少量的MgCl2,可加入适量KOH溶液,再过滤 |
6.设NA表示阿伏加德罗常数.下列说法中错误的是( )
| A. | 0.1mol/L的NaClO溶液中含ClO-的浓度小于0.1mol/L | |
| B. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| C. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答: