题目内容
13.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
分析 V=5L、△t=30s,△n(NO)=0.3mol,带入v(NO)=$\frac{△n(NO)}{V•△t}$,根据速率之比等于化学计量数之比计算.
解答 解:半分钟后NO的物质的量增加了0.3mol,则用NO表示的反应的平均速率v(NO)=$\frac{0.3mol}{5L×30s}=0.002mol/(L•s)$.
又因为反应速率之比是化学计量数之比,所以v(NH3)=0.002mol/(L•s)、v(O2)=0.0025mol/(L•s)、v(H2O)=0.003mol/(L•s),
故选C.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握反应速率的计算及数量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1NaHS溶液中:c(H+)=c(OH-)+c(S2-)+c(HS-) | |
| C. | 将0.1 mol•L-1Na2CO3溶液和0.2 mol•L-1NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
1.下列物质溶于水后,能使水的电离程度增大的是( )
| A. | NO2 | B. | Ba(OH)2 | C. | Cl2 | D. | CH3COONa |
18.近年来,科学家研制了一种新型的乙醇燃料电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
| A. | 乙醇在电池的负极上参加反应 | |
| B. | 1mol CH3CH2OH被氧化转移6mole- | |
| C. | 随着反应的进行,正极附近的酸性减弱 | |
| D. | 电池放电过程中化学能转化成电能 |
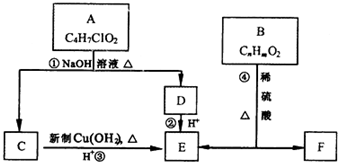
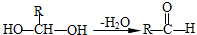
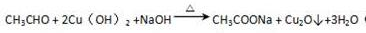

 .
. ;
;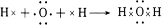 ;
;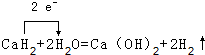 .
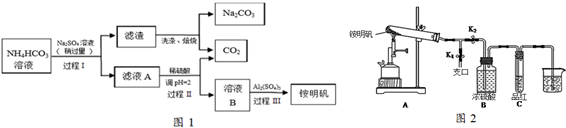
.
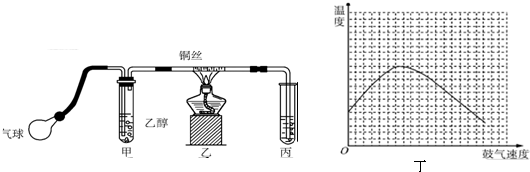
 .
.