题目内容
3.春节期间,在娱乐、购物、旅游时要讲究文明、保护环境.①用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中.聚乙烯的结构简式是
 .
.②不法商贩会用由铜锌合金打造的假金首饰欺骗消费者.请写出检验金首饰真假的化学方法和结论将首饰投入盛有盐酸的烧杯中,若有气泡生成证明是假金首饰.
③许多城市禁放烟花爆竹.制作烟花爆竹的黑火药用木炭、硝酸钾、硫磺配制,黑火药爆炸时会生成氮气、硫化钾和二氧化碳.写出该反应的化学方程式3C+S+2KNO3=3CO2↑+K2S+N2↑.
分析 ①聚乙烯是乙烯通过加聚反应生成的,它属于高分子材料;
②锌能与酸反应生成氢气,金不能与酸反应;
③根据木炭、硫磺、硝石反应后生成硫化钾、氮气和二氧化碳进行分析.
解答 解:①聚乙烯是乙烯通过加聚反应生成的,则聚乙烯的结构简式为: ,聚乙烯为高分子化合物;
,聚乙烯为高分子化合物;
故答案为:
②锌能与酸反应生成氢气,金不能与酸反应,所以将首饰投入盛有盐酸的烧杯中,若有气泡生成,证明是假金首饰;
故答案为:将首饰投入盛有盐酸的烧杯中,若有气泡生成证明是假金首饰;
③木炭、硫磺、硝石在点燃的条件下生成硫化钾、氮气和二氧化碳,故答案为:S+3C+2KNO3 $\frac{\underline{\;点燃\;}}{\;}$K2S+N2↑+3CO2↑;
故答案为:3C+S+2KNO3=3CO2↑+K2S+N2↑.
点评 本题可考查了聚合物、化学方程式的书写,明确加聚反应实质、相关物质的性质是解题关键,注意化学方程式应遵循客观事实,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
13.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
14.X、Y、Z、W为四种短周期主族元素,且原子序数依次递增,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,下列说法正确的是( )
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
11.我国在全球最先发现天然金属铀.下列对铀元素的一种核素的说法正确的是( )
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
18. 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
8.如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
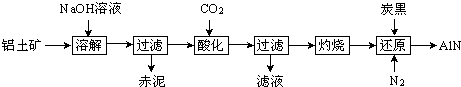
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
①该样品中AlN的质量分数为多少?(写出计算过程)
②所用NaOH溶液的浓度为9.5mol/L.

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
②所用NaOH溶液的浓度为9.5mol/L.
15.利用废旧铝合金(主要成分:Al、Fe、Mg)易拉罐制备钾明矾晶体[KAl(SO4)2•12H2O,式量474].制备步骤如下:
步骤1、铝片的准备
①去除易拉罐表面的漆膜;②用剪刀剪成小铝片,称2克备用
步骤2、钾明矾的制备
方案一:
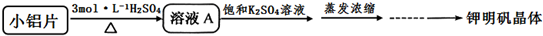
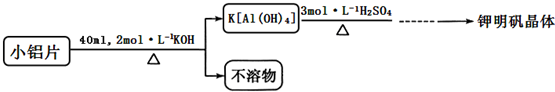
方案二:
相关信息如下:
①钾明矾为正八面体晶型,有玻璃光泽,密度1.757g/cm3,熔点92.5℃.64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,难溶于乙醇.
②相关物质的溶解度:
请回答下列问题:
(1)下列方法不能去除易拉罐表面漆膜(主要成分为烃类化合物)的方法是B.
A.灼烧B.饱和碳酸钠溶液浸泡C.砂纸打磨D.有机溶剂浸泡
(2)方案一中的硫酸浓度不宜过稀也不宜过浓,原因是硫酸浓度过稀反应速率过慢,浓度过高会使铝片钝化;蒸发浓缩后的操作步骤是冷却结晶、过滤、洗涤、干燥;干燥时应控制温度64.5℃以下.
(3)实际实验中往往采用方案二,写出其可能的两条理由①方案一制备晶体中含有较多铁镁硫酸盐等杂质;②方案一反应速率较慢;方案二制备钾明矾晶体时为什么不再加入K2SO4饱和溶液?2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O(用方程式表示)
(4)最后得到钾明矾晶体质量为 31.5g,产率为89.7%.(保留3位有效数字)
步骤1、铝片的准备
①去除易拉罐表面的漆膜;②用剪刀剪成小铝片,称2克备用
步骤2、钾明矾的制备
方案一:
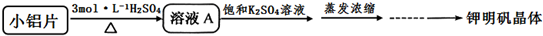
方案二:

相关信息如下:
①钾明矾为正八面体晶型,有玻璃光泽,密度1.757g/cm3,熔点92.5℃.64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,难溶于乙醇.
②相关物质的溶解度:
| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
(1)下列方法不能去除易拉罐表面漆膜(主要成分为烃类化合物)的方法是B.
A.灼烧B.饱和碳酸钠溶液浸泡C.砂纸打磨D.有机溶剂浸泡
(2)方案一中的硫酸浓度不宜过稀也不宜过浓,原因是硫酸浓度过稀反应速率过慢,浓度过高会使铝片钝化;蒸发浓缩后的操作步骤是冷却结晶、过滤、洗涤、干燥;干燥时应控制温度64.5℃以下.
(3)实际实验中往往采用方案二,写出其可能的两条理由①方案一制备晶体中含有较多铁镁硫酸盐等杂质;②方案一反应速率较慢;方案二制备钾明矾晶体时为什么不再加入K2SO4饱和溶液?2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O(用方程式表示)
(4)最后得到钾明矾晶体质量为 31.5g,产率为89.7%.(保留3位有效数字)
12.下列说法正确的是( )
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
1.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |