题目内容
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1NaHS溶液中:c(H+)=c(OH-)+c(S2-)+c(HS-) | |
| C. | 将0.1 mol•L-1Na2CO3溶液和0.2 mol•L-1NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
分析 A.溶液中存在电荷守恒分析;
B.依据溶液中电荷守恒分析判断;
C.溶液中存在物料守恒3n(Na)=4n(C);
D.向0.1 mol•L-1NaHSO4溶液中滴加氨水至溶液恰好呈中性,c(H+)=c(OH-),依据溶液中物料守恒和电荷守恒计算分析判断;
解答 解:A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合溶液中为醋酸和醋酸钠的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.在0.1 mol•L-1NaHS溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+2c(S2-)+c(HS-),质子守恒c(Na+)=c(S2-)+c(H2S)+c(HS-),c(H+)+c(H2S)=c(OH-)+c(S2-),故B错误;
C.将0.1 mol•L-1Na2CO3溶液和0.2 mol•L-1NaHCO3溶液等体积混合,溶液中存在物料守恒3n(Na)=4n(C),3c(Na+)=4c(CO32-)+4c(HCO3-)+4c(H2CO3),故C错误;
D.向0.1 mol•L-1NaHSO4溶液中滴加氨水至溶液恰好呈中性,c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-),得到c(Na+)+c(NH4+)=2c(SO42-),溶液中存在物料守恒c(Na+)=c(SO42-),得到c(Na+)=c(NH4+)=c(SO42-)>c(H+)=c(OH-),故D正确;
故选AD.
点评 本题考查了电解质溶液中离子浓度大小比较,溶液中电荷守恒、电荷守恒、物料守恒的分析和判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.在饱和澄清石灰水中加入生石灰反应后,恢复至原来温度下列说法正确的是( )
| A. | 溶液的PH不变 | B. | 溶液中氢氧化钙的质量分数增大 | ||
| C. | 溶液中钙离子浓度变大 | D. | 溶液中钙离子的物质的量减少. |
14.下列有关Al(NO3)3溶液的叙述正确的是( )
| A. | 该溶液中H+、Fe2+、SO42-、Cl-可以大量共存 | |
| B. | 向该溶液中通入SO2气体不会发生反应 | |
| C. | 向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3•H2O═AlO2-+4NH4++2H2O: | |
| D. | 向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO32-+3 H2O═2Al(OH)3↓+3CO2↑ |
11.下列化学用语表示正确的是( )
| A. | HClO的电子式: | |
| B. | 质子数为94、中子数为145的钚(Pu)原子:${\;}_{94}^{145}$Pu | |
| C. | 氯离子的结构示意图: | |
| D. | 对二甲苯的结构简式: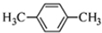 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
8.中华民族很早就把化学技术应用到生产、生活中.下列有关说法错误的是( )
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
15.下列对有关实验操作产生的影响及原因分析都正确的是( )
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
12.化学反应原理在工业生产中具有十分重要的意义.
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下(如图1):

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ•mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数K的表达式为K=$\frac{c(CO)}{c(C{O}_{2})}$,a>0(填“>”、“<”或“=”).在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4mol,则5min后达到平衡时CO2的转化率为50%,生成CO的平均速率v (CO)为0.2mol/(L•min).
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加CO2的量、升高温度.
(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O?CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下(如图1):

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ•mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加CO2的量、升高温度.
(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O?CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
13.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |