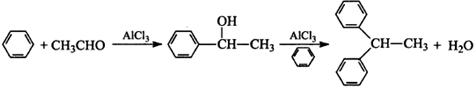
题目内容
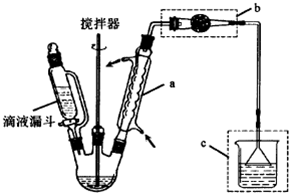
2.某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等固定装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.请填写下列空白: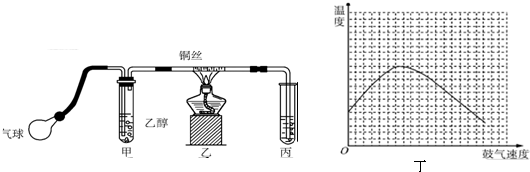
(1)检验乙醛的试剂是A C(填字母).
A.银氨溶液 B.碳酸氢钠溶液 C.新制Cu(OH)2 D.氧化铜
(2)乙醇发生催化氧化反应的化学方程式为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
(3)实验时,常常将甲装置浸在70~80℃的水浴中,目的是适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流,由于装置设计上的缺陷,实验进行时可能会发生倒吸.
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反 应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图丁所示.试解释鼓气速度过快,反应体系温度反而下降的原因过量的气体将体系中的热量带走,该实验中“鼓气速度”这一变量你认为可用单位时间内甲中的气泡量来估量.
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色.该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确?用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确;反之,猜想②.
分析 (1)醛类物质含有醛基,能够被银氨溶液、新制的氢氧化铜氧化;
(2)乙醇催化氧化生成乙醛和水;
(3)根据加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;根据导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水产生倒吸现象;
(4)根据鼓气的速度和反应体系温度之间的关系来回答;
(5)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液仍为中性,故可利用酸碱指示剂来确定哪种猜想是正确的.
解答 解:(1)乙醛中具有醛基,能够被银氨溶液、新制的氢氧化铜氧化,可以使用银氨溶液或新制氢氧化铜溶液来检验,
故选:A C;
(2)乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
(3)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;发生倒吸;
(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,
故答案为:过量的气体会将体系中的热量带走;单位时间内甲中的气泡数;
(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性;乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,故操作方法为:用pH试纸检测溴水与褪色后溶液的酸碱性,若酸性明显增强,则猜想①正确,反之猜想②正确,
故答案为:用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确.
点评 本题通过乙醇的催化氧化实验考查了乙醇、乙醛的性质,物质检验方案的设计,明确乙醇的结构及性质是解题关键,侧重考查分析、理解能力及化学实验能力,题目难度中等.

(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下(如图1):

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ•mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加CO2的量、升高温度.
(3)利用CO与H2可直接合成甲醇,图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O?CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2 (标准状况下),电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |