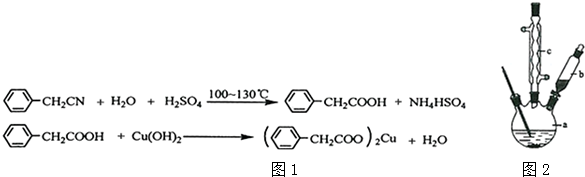
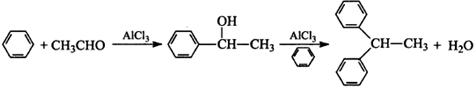
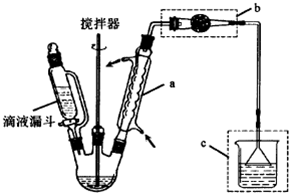
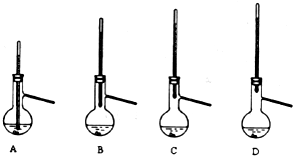
题目内容
18.近年来,科学家研制了一种新型的乙醇燃料电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )| A. | 乙醇在电池的负极上参加反应 | |
| B. | 1mol CH3CH2OH被氧化转移6mole- | |
| C. | 随着反应的进行,正极附近的酸性减弱 | |
| D. | 电池放电过程中化学能转化成电能 |
分析 酸性乙醇燃料电池总反应为C2H5OH+3O2═2CO2+3H2O,负极乙醇被氧化生成CO2,电极反应式为C2H5OH-12e-+3H2O═2CO2+12H+,正极氧气得电子生成H2O,电极反应式为4H++O2+4e-═2H2O,结合原电池的工作原理解答该题.
解答 解:A、乙醇燃料电池中,乙醇在负极失电子参加反应,故A正确;
B、根据C2H5OH+3O2=2CO2+3H2O 转移12e-,可得1mol CH3CH2OH被氧化转移12mole-,故B错误;
C、该乙醇燃料电池用酸性电解质(H+)作溶剂,所以正极反应为O2+4e-+4H+=2H2O,随着反应的进行,H+不断被消耗,溶液酸性减弱,故C正确;
D、电池放电是原电池原理,化学能转化成电能,故D正确;
故选B.
点评 本题考查化学电源新型电池的工作原理,题目难度中等,解答本题的关键是能根据电池总反应判断正负极,并能写出电极反应式,为解答该题的易错点,注意把握.

练习册系列答案
相关题目
8.中华民族很早就把化学技术应用到生产、生活中.下列有关说法错误的是( )
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
6.下列反应中,说明氨有还原性和碱性的是( )
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
13.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
7.下列说法不正确的是( )
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
8.如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
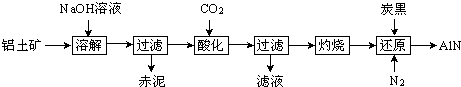
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
①该样品中AlN的质量分数为多少?(写出计算过程)
②所用NaOH溶液的浓度为9.5mol/L.

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为Fe2O3、Na2Al2Si2O8(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为NaHCO3(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
②所用NaOH溶液的浓度为9.5mol/L.