题目内容
3.电池是人类生产和生活中的重要能量来源,各式各样的电池的发展是化学对人类的一项重大贡献(1)下列有关电池的叙述中正确的是C.
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
(2)FeCl3溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为Cu,正极反应式为2Fe3++2 e-=2Fe2+.
(3)将铁片和铜片浸入硫酸铜溶液中组成原电池,两电极间连接一个电流计.若开始该电池中两电极的总质量为200g,工作一段时间后,取出铁片和铜片洗净干燥后称重,总质量变为208g,试计算:①溶解的铁的质量56g;②通过导线的电子数目2NA.
(4)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点.氢-氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式可表示为2H2+O2=2H2O.酸式燃料电池的电解质是酸,其负极反应可表示为:2H2-4e-═4H+,则其正极反应式可表示为:O2+4H++4e-═2H2O;放电一段时间后电解质溶液的pH将变大(填“变大、变小、不变”)碱式氢-氧燃料电池中的电解质是碱,其正极反应式为:O2+2H2O+4e-=4OH-,则其负极反应可表为:2H2+4OH--4e-=4H2O.
分析 (1)A.锌锰干电池工作时碳棒不参与反应;
B.燃料电池可将化学能直接转变为电能;
C.氢氧燃料电池中,燃料在负极失电子;
D.太阳能电池的主要材料是硅;
(2)该电池反应中,铜失电子发生氧化反应,作负极;正极上铁离子得电子;
(3)依据该电池中两电极的总质量为200g,工作一段时间后,铁片和铜片洗净干燥后称重,总质量变为208g,分析判断电极质量增大为析出的Cu的质量与溶解的Fe的质量之差,依据电极反应和电子守恒计算;
(4)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式,根据溶液中氢离子浓度的变化判断溶液PH值的变化.
解答 解:(1)A.锌锰干电池工作时碳棒不参与反应,所以碳棒质量不变,故A错误;
B.燃料电池反应中没有发生燃烧反应,放出的热能很少,主要是把化学能直接转变为电能,故B错误;
C.氢氧燃料电池工作时,燃料在负极失电子被氧化,则甲烷燃料电池工作时甲烷在负极被氧化,故C正确;
D.太阳能电池的主要材料为硅,光导纤维的主要材料是二氧化硅,故D错误;
故答案为:C;
(2)该电池反应中,铜失电子发生氧化反应,作负极;正极上铁离子得电子,则正极反应式为:2Fe3++2 e-=2Fe2+;
故答案为:Cu;2Fe3++2 e-=2Fe2+;
(3)①依据该电池中两电极的总质量为200g,工作一段时间后,铁片和铜片洗净干燥后称重,总质量变为208g,电极质量增大为析出的Cu的质量与溶解的Fe的质量之差为8g,设转移电子为xmol,
Fe发生的反应:Fe-2e-═Fe2+;Cu电极上的反应Cu2++2e-═Cu,则n(Fe)=0.5xmol,n(Cu)=0.5xmol,所以64×0.5x-56×0.5x=8,解得x=2mol
所以m(Fe)=1mol×56g/mol=56g;
故答案为:56g;
②转移电子为2mol,则转移电子数为2NA;
故答案为:2NA;
(4)酸式燃料电池的电解质是酸,反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+;氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的PH值增大;
碱式氢-氧燃料电池中的电解质是碱,该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;
故答案为:2H2-4e-═4H+;O2+4H++4e-═2H2O;变大;2H2+4OH--4e-=4H2O.
点评 本题考查了原电池原理的分析判断、电极反应、电极名称、电子守恒的计算应用,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握原电池中电极的判断和电极方程式的书写.

| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCH2Br | D. | BrCH2CH2CH2CH2Br |
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦Na[Al(OH)4].
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ①②③④ | D. | 全部 |
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |

| A. | 该铜铂电池属于二次电池 | |
| B. | 电子移动方向与纳米发动机移动方向相同 | |
| C. | 铜为铜柏电池的正极 | |
| D. | 铂极发生的电极反应为HBrO+H++2e-=Br-+H2O |
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-离子的还原性依次为:F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来 |
 ,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.
,一个该有机物分子中含有2个手性碳原子.其中-NH2中N的杂化轨道类型是sp3.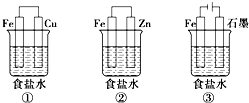 铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.