题目内容
11.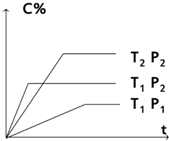 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,则:
(1)P1<P2;T1>T2
(2)m+n>p
(3)该反应正反应为放热反应.
分析 (1)根据“先拐先平,数值大”原则,采取定一议二解答;
(2)根据压强越大,C的含量越高,平衡向逆反应进行来分析;
(3)根据温度越高,C的含量越低,平衡向正反应进行来分析.
解答 解:(1)定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1<P2,定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,故答案为:<;>;
(2)由(1)知,压强P1<P2,由图知压强越大,C的含量越高,所以平衡向正反应进行,增大压强,平衡向体积减小的方向移动,所以m+n>p
,故答案为:>;
(4)由(1)知,温度T1>T2,由图知温度越高,C的含量越低,所以平衡向逆反应进行,升高温度,平衡向吸热方向移动,故正反应为放热反应,△H<0,故答案为:放热.
点评 本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,题目难度不大,做题时注意分析图象曲线的变化特点,根据“先拐先平,数值大”原则,采取定一议二解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列叙述中不正确的是( )
| A. | Na2O2是淡黄色固体,Na2O 是白色固体,二者都能与水反应生成 NaOH | |
| B. | Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O | |
| C. | Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 | |
| D. | 2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
3.下列关于NH3性质的说法正确的是( )
| A. | 收集时采用向上排空气法 | B. | 能使湿润的红色石蕊试纸变蓝 | ||
| C. | 可用浓硫酸进行干燥 | D. | 不能与氧气反应 |
 .
.
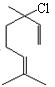 ;
;
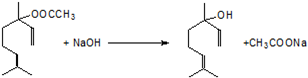 ,.
,. .
.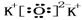 .
.