题目内容
1.A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3两种化合物.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.请回答下列问题:①D元素在元素周期表中的位置是第四周期第ⅠA族.
②A与D所形成的化合物的电子式为
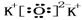 .
.③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为Cl2+S2-=2Cl-+S↓.
分析 A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA2、BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl,据此解答.
解答 解:A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,结合原子序数可知,D为K、C为Cl,
①D为K元素,在元素周期表中的位置是:第四周期第ⅠA族,故答案为:第四周期第ⅠA族;
②A与D所形成的化合物为K2O,电子式为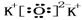 ,故答案为:
,故答案为: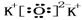 ;
;
③将氯气的水溶液滴加到K2S的水溶液中,硫离子被氧化生成硫,氯气被还还原,同时生成KCl,反应的化学方程式为:Cl2+K2S=2KCl+S↓,
故答案为:Cl2+S2-=2Cl-+S↓.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
9.NaClO2可用作造纸的漂白剂,它由:H2O2+2ClO2+2NaOH═2NaClO2+2H2O+O2制得,下列说法正确的是( )
| A. | H2O2是氧化剂,H2O2中的氧元素被还原 | |
| B. | 每生成1 mol O2转移的电子的物质的量为2 mol | |
| C. | ClO2中的氯元素被氧化 | |
| D. | ClO2是氧化剂,H2O2是还原剂 |
16.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 用热的纯碱溶液清除灶具上的油污 | |
| B. | 用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用明矾[KAl(SO4)2•12H2O]作净水剂,除去水中悬浮的杂质 |
6.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 开始蒸馏时,应该先通冷凝水,再加热;蒸馏完毕,应该先撤酒精灯再停通冷凝水 | |
| C. | 使用托盘天平称量物质时,先取小砝码,再依次取较大的砝码 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
13.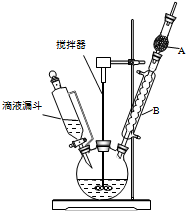 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
③三苯甲醇的相对分子质量为260.
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
粗产品$\stackrel{①操作}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$三苯甲醇,其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 | 沸点/℃ |
| 三苯甲醇[ | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
粗产品$\stackrel{①操作}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$三苯甲醇,其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
10.水的电离平衡曲线如图所示,下说法不正确的是( )


| A. | 图中四点Kw间的关系:A=D<C<B | |
| B. | 若从A点到D点,可采用:温度不变在水中加少量酸 | |
| C. | 若从A点到C点,可采用:温度不变在水中加少量NaAc固体 | |
| D. | 若从A点到D,可采用:温度不变在水中加少量NaAc固体 |
11.某人按下列方法测定样品中Na2O2的含量:城区一定量样品溶于足量的水,Na2O2+2H2O═2NaOH+H2O2,H2O2$\frac{\underline{\;NaOH\;}}{\;}$H2O+$\frac{1}{2}$O2.根据生成O2的量计算样品中Na2O2的纯度,他仔细实验多次,得到Na2O2含量均明显低于实际含量,这是因为( )
| A. | 称量错误 | |
| B. | H2O2分解不完全 | |
| C. | Na2O2转化为Na0H和H2O2的反应不完全 | |
| D. | 装置漏气 |
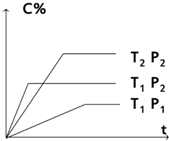 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,