题目内容
20.现有下列4种重要的有机物:①乙醇、②乙醛、③溴乙烷、④甲苯.请回答:(1)能发生取代反应生成①的是①③(填序号).
(2)能发生消去反应生成乙烯的是①③(填序号).
(3)能和银氨溶液发生银镜反应的是②(填序号).
(4)写出④与浓硝酸和浓硫酸的混合物发生硝化反应生成TNT的化学方程式:
 .
.
分析 (1)醇类、卤代烃可发生取代反应;
(2)醇类、卤代烃可发生消去反应;
(3)含有醛基的物质能发生银镜反应;
(4)甲苯与浓硝酸反应生成TNT.
解答 解:(1)醇类中的羟基能被氯原子取代,卤代烃可发生水解反应,都属于取代反应,故答案为:①③;
(2)乙醇能发生消去反应生成乙烯,溴乙烷可在氢氧化钠的乙醇溶液中发生消去反应生成乙烯,故答案为:①③;
(3)乙醛中含有-CHO,-CHO能发生银镜反应,故答案为:②;
(4)甲苯与浓硝酸在浓硫酸作催化剂,加热条件下反应生成 ,其反应方程式为:
,其反应方程式为: ;
;
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醛、苯酚及卤代烃性质的考查,注意有机反应类型及性质的关系,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
8.当光束通过下列物质时,不可能观察到丁达尔效应的是( )
| A. | 稀豆浆 | B. | NaCl溶液 | C. | Fe(OH)3胶体 | D. | H2SiO3胶体 |
15.下列行为符合实验安全要求的是( )
| A. | 大量氯气泄漏时,匍匐前进,尽快离开现场 | |
| B. | 用点燃的火柴在液化气管道接口处检验是否漏气 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用湿抹布盖灭 | |
| D. | 实验室做完苯的性质实验后,废液可直接排入下水道 |
5.工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
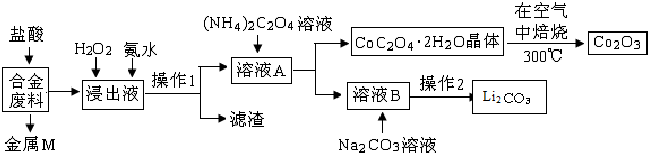
已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+CO2↑.
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极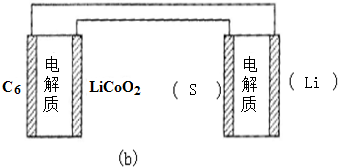 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.
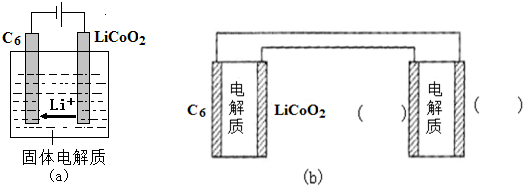

已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极
 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.
9.NaClO2可用作造纸的漂白剂,它由:H2O2+2ClO2+2NaOH═2NaClO2+2H2O+O2制得,下列说法正确的是( )
| A. | H2O2是氧化剂,H2O2中的氧元素被还原 | |
| B. | 每生成1 mol O2转移的电子的物质的量为2 mol | |
| C. | ClO2中的氯元素被氧化 | |
| D. | ClO2是氧化剂,H2O2是还原剂 |
10.水的电离平衡曲线如图所示,下说法不正确的是( )
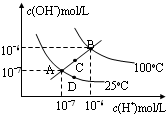

| A. | 图中四点Kw间的关系:A=D<C<B | |
| B. | 若从A点到D点,可采用:温度不变在水中加少量酸 | |
| C. | 若从A点到C点,可采用:温度不变在水中加少量NaAc固体 | |
| D. | 若从A点到D,可采用:温度不变在水中加少量NaAc固体 |
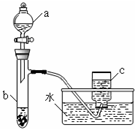 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.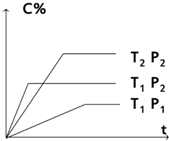 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,