题目内容
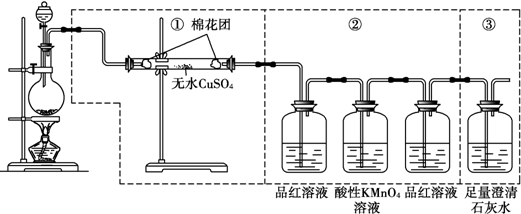
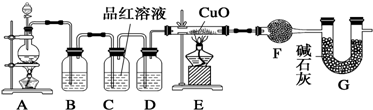
9.为了验证炭粉与浓硫酸作用确实有二氧化碳气体生成,某同学创设如下图所示的A、B、C三个装置进行实验,其中省略了课本上炭粉与浓硫酸反应的发生装置图.已知C中的KMnO4酸性溶液是足量的,具有强氧化性,还原性的SO2气体经过KMnO4酸性溶液后能全部被吸收氧化,据此,请回答下列问题.
(1)炭粉与浓硫酸在加热条件下反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(2)由(1)产生的混合气体流经装置A、B、C的先后顺序是C、B、A(填A、B、C),气流依次经过装置管口顺序号为(填管口序号a、b、c、d、e、f);气体发生装置导管口接e,然后f接c,d接a;
(3)装置B的作用是验证SO2是否被除尽,装置B中观察到的现象是品红溶液仍保持红色;
(4)装置A中观察到的现象是溶液变浑浊,得到的结论是混合气体中含CO2.
分析 碳和浓硫酸反应生成二氧化碳、二氧化硫、水,验证红热的炭与与浓硫酸发生反应所生成的产物含有二氧化碳,按气体流动方向设计了一个实验流程,其所使用的试剂次序可以表示为:气体产物→酸性高锰酸钾溶液→品红溶液→澄清石灰水;
(1)炭粉与浓硫酸在加热条件生成二氧化碳、二氧化硫和水;
(2)碳和浓硫酸反应生成二氧化碳、二氧化硫、水,二氧化碳、二氧化硫都能使澄清石灰水变浑浊,所以要检验二氧化碳的存在应排除二氧化硫的干扰;
(3)二氧化硫具有漂白性,能够使品红溶液褪色;
(4)二氧化碳与氢氧化钙反应生成碳酸钙和数,能够使澄清石灰水变浑浊.
解答 解:(1)在加热条件下,碳与浓硫酸反应生成二氧化碳气体、二氧化硫气体和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2);验证产物中的二氧化碳用①澄清石灰水,二氧化硫也能使澄清石灰水变浑浊,所以需要先用品红验证二氧化硫的存在,通过高锰酸钾溶液除去二氧化硫,再通过品红验证二氧化硫是否除净,避免影响二氧化碳气体,所以由(1)产生的混合气体流经装置A、B、C的先后顺序是C、B、A;气体发生装置导管口接e,然后f接c,d接a;
故答案为:C;B;A; e;f;c;d;a;
(3)二氧化硫具有漂白性,能够使品红溶液褪色,所以装置B的作用是验证SO2是否被除尽,如果装置B中观察到的现象是品红溶液仍保持红色,说明二氧化硫被除尽;
故答案为:验证SO2是否被除尽; 品红溶液仍保持红色;
(4)二氧化碳与氢氧化钙反应生成碳酸钙和数,能够使澄清石灰水变浑浊,若二氧化碳存在,则可以看到装置A中观察到的现象是溶液变浑浊;
故答案为:溶液变浑浊;混合气体中含CO2.
点评 本题考查了浓硫酸的性质、性质实验方案的设计,题目难度中等,注意检验二氧化碳的存在情况时,表现排除二氧化硫的干扰,明确常见气体的性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案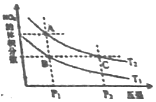 反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点的化学平衡常数:A>C | |
| C. | A、C两点N2O4的转化率:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
| A. | NaHCO3溶液 | B. | NaHSO3溶液 | C. | CH3COONa溶液 | D. | Na2HPO4溶液 |
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
| A. | 改变外界条件不能改变化学反应的限度 | |
| B. | 当某反应在一定条件下达到反应限度时即达到化学平衡状态 | |
| C. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| D. | 能自发进行的反应其速率都很大 |