题目内容
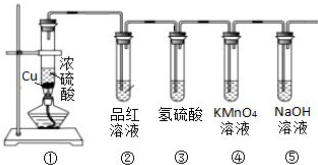
1.化学小组同学依据化学反应Zn+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$ZnSO4+SO2↑+2H2O制取22.4L(标准状况)SO2气体.取65.0g锌粒与110mL 98%的浓H2SO4充分反应,锌全部溶解.对于制得的气体,有同学认为可能混有氢气.为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究.(F中为无水硫酸铜)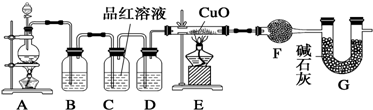
请回答下列问题:
(1)装置A中添加液体的仪器名称为分液漏斗; 98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度是18.4 mol/L;
(2)装置B是为了吸收SO2,则不能选用下列试剂中的B(填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
(3)装置D的作用是干燥气体;
(4)可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是E中黑色固体变红,F中白色固体变蓝.
分析 (1)依据仪器形状说出仪器名称;依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)依据二氧化硫为酸性氧化物,具有还原性的性质解答;
(3)E为加热装置,所以为防止硬质试管炸裂,进入的气体不能含有水蒸气;
(4)氢气具有还原性,能还原氧化铜,且生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)依据仪器形状可知装置A中添加液体的仪器名称为分液漏斗; 98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度是:$\frac{1000×1.84×98%}{98}$=18.4mol/L;
故答案为:分液漏斗; 18.4 mol/L;
(2)A.二氧化硫为酸性氧化物,能够与氢氧化钠反应被氢氧化吸收,故A不选;
B.浓硫酸与二氧化硫不反应,不能用来吸收二氧化硫,故B选;
C.高锰酸钾具有强氧化性,能够氧化二氧化硫,可以用高锰酸钾吸收二氧化硫,故C不选;
故选:B;
(3)E为加热装置,所以为防止硬质试管炸裂,进入的气体不能含有水蒸气,所以D的作用为干燥气体;
故答案为:干燥气体;
(4)氢气具有还原性,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果有氢气,看到的现象是:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色,
故答案为:E中黑色固体变红,F中白色固体变蓝.
点评 本题考查了探究实验,明确实验原理是解本题关键,根据物质的性质来分析解答,注意二氧化硫的漂白性,为常考查点.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
5.下列关于胶体的叙述不正确的是( )
| A. | 将1mL饱和氯化铁溶液逐滴加入到20mL温水中,边加边搅拌 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
6.在酸性溶液中能大量共存而且溶液为无色透明的是( )
| A. | Na+、Al3+、SO42-、NO3- | B. | K+、Na+、SO42-、Ba2+ | ||
| C. | K+、MnO4-、NH4+、Cl- | D. | Cu2+、K+、HCO3-、NO3- |
13.工业合成氨的反应是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂.已知形成1 mol H-H键、1 mol N-H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ.则:
(1)写出工业合成氨的化学方程式N2(g)+3H2(g)?2NH3(g).
(2)若0.5mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量46kJ.
(3)如果将0.5mol N2和1.5mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ.
(4)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过5min后,数据如下,则用N2表示的化学反应速率为0.4mol/L/min.
(5)一定条件下,当合成氨的反应达到化学平衡时,下列说法不正确的是bde.
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度.
(1)写出工业合成氨的化学方程式N2(g)+3H2(g)?2NH3(g).
(2)若0.5mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量46kJ.
(3)如果将0.5mol N2和1.5mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ.
(4)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过5min后,数据如下,则用N2表示的化学反应速率为0.4mol/L/min.
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度.
10.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
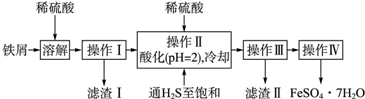
查询资料,得有关物质的相关数据如表:
(1)操作Ⅱ中,通入硫化氢至饱和的目的是除去溶液中的Sn2+;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀,并防止Fe2+被氧化.
(2)滤渣Ⅱ的主要成分是SnS.
(3)操作Ⅳ得到的绿矾晶体用少量冰水此空删去洗涤,其目的是:此空删去
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.

| 25℃时 | pH[] |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是除去溶液中的Sn2+;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀,并防止Fe2+被氧化.
(2)滤渣Ⅱ的主要成分是SnS.
(3)操作Ⅳ得到的绿矾晶体用少量冰水此空删去洗涤,其目的是:此空删去
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.