题目内容
19.下列说法中正确的是( )| A. | 改变外界条件不能改变化学反应的限度 | |
| B. | 当某反应在一定条件下达到反应限度时即达到化学平衡状态 | |
| C. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| D. | 能自发进行的反应其速率都很大 |
分析 A.外界条件改变,如正逆反应速率不等,则化学反应的限度改变;
B.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态;
C.浓度、压强不改变活化分子百分数;
D.能自发进行的反应速率不一定大.
解答 解:A.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态,当外界条件改时,正逆反应速率可以改变,反应限度也改变,故A错误;
B.对于可逆反应,反应的最大限度即为正逆反应速率相等,也就是处于平衡状态,故B正确;
C.浓度、压强不改变活化分子百分数,只概念单位体积的活化分子数目,故C错误;
D.反应能否自发进行,取决于焓变和熵变,与反应速率无关,故D错误.
故选B.
点评 本题主要考查化学平衡的特征及影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,难度不大,解题时注意基本概念和基本原理的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
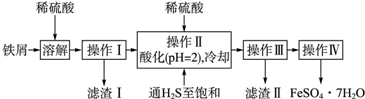
查询资料,得有关物质的相关数据如表:
(1)操作Ⅱ中,通入硫化氢至饱和的目的是除去溶液中的Sn2+;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀,并防止Fe2+被氧化.
(2)滤渣Ⅱ的主要成分是SnS.
(3)操作Ⅳ得到的绿矾晶体用少量冰水此空删去洗涤,其目的是:此空删去
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.

| 25℃时 | pH[] |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是除去溶液中的Sn2+;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀,并防止Fe2+被氧化.
(2)滤渣Ⅱ的主要成分是SnS.
(3)操作Ⅳ得到的绿矾晶体用少量冰水此空删去洗涤,其目的是:此空删去
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.5%.
7.N2O5是一种新型硝化剂,在一定温度下向密闭容器中通入N2O5气体,发生如下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.部分实验数据见表:
下列说法中不正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
14.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
a、b、c、d与m、n、x、y之间的关系式为.
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
4.已知:CO(g)+2H2(g)?CH3OH(g)△H<0.其它条件不变的情况下,下列有关该反应的说法中正确的是( )
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
8.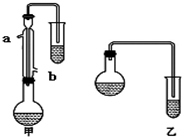 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
(1)甲和乙两位同学分别设计了如下图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(2)实验中浓硫酸的作用是催化剂、吸水剂.
(3)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
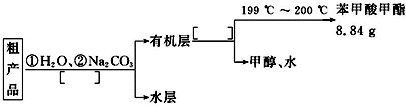
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称.
 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(2)实验中浓硫酸的作用是催化剂、吸水剂.
(3)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称.

9.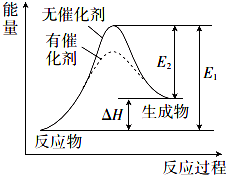 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
