题目内容
下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.
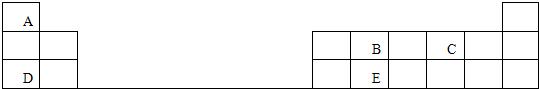
请填写下列空白:
(1)A与B形成BA4的电子式为 ;C的原子结构示意图为 .
(2)C与D的单质在不同条件下反应,生成物的化学式分别为 、 .
(3)E位于周期表的第三周期、第 族;E的氧化物与氢氧化钠溶液反应的离子方程式为 .

请填写下列空白:
(1)A与B形成BA4的电子式为
(2)C与D的单质在不同条件下反应,生成物的化学式分别为
(3)E位于周期表的第三周期、第
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,A为氢、B为碳、C为氧、D为Na、E为Si,
(1)A与B形成CH4,分子中C原子与H原子之间形成1对共用电子对;C为O元素,原子核外有2个电子层,各层电子数为2、6;
(2)钠与氧元素可以形成氧化钠、过氧化钠;
(3)主族元素主族族序数=最外层电子数;二氧化硅与氢氧化钠反应生成硅酸钠与水.
(1)A与B形成CH4,分子中C原子与H原子之间形成1对共用电子对;C为O元素,原子核外有2个电子层,各层电子数为2、6;
(2)钠与氧元素可以形成氧化钠、过氧化钠;
(3)主族元素主族族序数=最外层电子数;二氧化硅与氢氧化钠反应生成硅酸钠与水.
解答:
解:由元素在周期表中的位置可知,A为氢、B为碳、C为氧、D为Na、E为Si,
(1)A与B形成CH4,分子中C原子与H原子之间形成1对共用电子对,电子式为 ;C为O元素,原子核外有2个电子层,各层电子数为2、6,原子结构示意图为
;C为O元素,原子核外有2个电子层,各层电子数为2、6,原子结构示意图为 ,
,
故答案为: ;
; ;
;
(2)钠与氧元素可以形成氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,故答案为:Na2O;Na2O2;
(3)E为Si元素,最外层电子数为4,处于ⅣA族;二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:ⅣA;SiO2+2OH-=SiO32-+H2O.
(1)A与B形成CH4,分子中C原子与H原子之间形成1对共用电子对,电子式为
 ;C为O元素,原子核外有2个电子层,各层电子数为2、6,原子结构示意图为
;C为O元素,原子核外有2个电子层,各层电子数为2、6,原子结构示意图为 ,
,故答案为:
 ;
; ;
;(2)钠与氧元素可以形成氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,故答案为:Na2O;Na2O2;
(3)E为Si元素,最外层电子数为4,处于ⅣA族;二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:ⅣA;SiO2+2OH-=SiO32-+H2O.
点评:本题考查元素周期表、常用化学用语,难度不大,侧重对化学用语考查,注意对基础知识理解掌握.

练习册系列答案
相关题目
下列溶液中,粒子浓度关系正确的是( )
| A、0.1mol/L的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| B、醋酸钠溶液与盐酸混合之后的中性溶液:c(Na+)>c(Cl-)>C(CH3COOH) |
| C、等浓度、等体积的氨水与盐酸的混合溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、pH=4的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) |
某学生撰写了一份“对四种无色溶液离子组成的检验”实验报告,合理的一组是( )
| A、Na+、Fe3+、Cl-、NO3- | ||||
| B、Mg2+、H+、NO3-、HCO3- | ||||
C、Ba2+、Na+、SO
| ||||
D、K+、Na+、SO
|




 ,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为
,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为 )
)

 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能--甲醇.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能--甲醇.