题目内容
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能--甲醇.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能--甲醇.(1)与CO互为等电子体的物质的化学式是
(2)CO2分子中碳原子的杂化类型是
(3)按电子排布Zn在元素周期表中属于
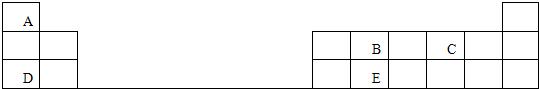
(4)Cu的一种氯化物晶体的晶胞结构如图所示(蓝色球代表氯离子),则一个晶胞中所含Cu原子的数目是
考点:晶胞的计算,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)原子总数、电子总数(或价电子)相等的微粒互为等电子体;
(2)CO2分子的结构为O=C=O,根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;
(3)Zn的外围电子排布为3d104s2,处于ds区;晶体属于六方最密堆积,Zn的配位数是12;
(4)Cu原子位于顶角、面心,根据均摊法计算.
(2)CO2分子的结构为O=C=O,根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;
(3)Zn的外围电子排布为3d104s2,处于ds区;晶体属于六方最密堆积,Zn的配位数是12;
(4)Cu原子位于顶角、面心,根据均摊法计算.
解答:
解:(1)原子数相同,电子总数(或价电子)相同的分子,互称为等电子体,CO中的电子数为14个,原子个数为2,则N2可与其互称为等电子体,
故答案为:N2;
(2)CO2分子的结构为O=C=O,C原子成2个σ键键、没有孤电子对,杂化轨道数目为2,故其杂化类型为sp杂化,
故答案为:sp;
(3)Zn元素的电子排布为1s22s22p63s23p63d104s2,其价电子层为3d104s2,因此属于ds区,当其晶体属于六方最密堆积,它的配位数是12,
故答案为:ds;12;
(4)Cu原子位于顶角、面心,1个晶胞中含有Cu原子数目=8×
+6×
=4,
故答案为:4.
故答案为:N2;
(2)CO2分子的结构为O=C=O,C原子成2个σ键键、没有孤电子对,杂化轨道数目为2,故其杂化类型为sp杂化,
故答案为:sp;
(3)Zn元素的电子排布为1s22s22p63s23p63d104s2,其价电子层为3d104s2,因此属于ds区,当其晶体属于六方最密堆积,它的配位数是12,
故答案为:ds;12;
(4)Cu原子位于顶角、面心,1个晶胞中含有Cu原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4.
点评:本题是对物质结构的考查,涉及等电子体、杂化理论、晶体结构与晶胞计算等,难度不大,对于等电子体的概念,一定要具有相同的原子个数,可以是电子总数或价电子)相同.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
在通常情况下,下列液体的pH大于7的是( )
| A、胃液 | B、食醋 |
| C、葡萄汁 | D、纯碱溶液 |
下列各组物质中,互称为同分异构体的是( )
| A、12C和14C |
| B、乙酸和醋酸 |
| C、正丁烷和异丁烷 |
| D、甲烷和丙烷 |
NA表示阿伏加德罗常数的值,下列有关说法不正确的是( )
| A、45g水中含有的水分子数是2.5NA |
| B、标准状况下,33.6LCO中含有的原子数是3NA |
| C、0.5L 0.2mol/L的NaCl(aq)中含有的Na+数是0.1NA |
| D、1molCH4中含电子数目为NA |