题目内容
6.下列各组同体积、同物质的量浓度的溶液混合后,所得溶液的pH不大于7的是( )①CH3COONa、HCl、NaHCO3②Na2S、KNO3、KCl③Ba(NO3)2、NH4Cl、Na2CO3④AgNO3、HCl、CH3COONa⑤K2CO3、HCl、HNO3⑥KCl、Na2S、HCl.
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②⑥ | D. | ②④⑥ |
分析 各组同体积、同物质的量浓度的溶液混合后,所得溶液的pH不大于7,说明混合液为中性或酸性,先分析混合液中溶质组成,然后结合盐的水解原理判断溶液酸碱性.
解答 解:同体积、同物质的量浓度,说明各溶液中含有溶质的物质的量相等,
①CH3COONa、HCl、NaHCO3:三者等物质的量混合后溶质为醋酸钠和氯化钠,由于醋酸根离子部分水解,溶液呈碱性,溶液的pH大于7,故①正确;
②Na2S、KNO3、KCl:三者等物质的量混合后不反应,硫离子部分水解,溶液呈碱性,溶液的pH大于7,故②正确;
③Ba(NO3)2、NH4Cl、Na2CO3:三者反应后溶质为氯化铵和氯化钠溶液,铵根离子部分水解,溶液呈酸性,溶液的pH<7,故③错误;
④AgNO3、HCl、CH3COONa:反应后溶质为氯化钠和醋酸,混合液显示酸性,溶液的pH小于7,故④错误;
⑤K2CO3、HCl、HNO3:反应后溶质为氯化钾、硝酸钾,溶液呈中性,溶液的pH=7,故⑤错误;
⑥KCl、Na2S、HCl:反应后溶质为氯化钾、NaHS、NaCl,HS-离子部分水解,溶液显示碱性,溶液的pH>7,故⑥正确;
根据分析可知,溶液的pH大于7的为:①②⑥,
故选C.
点评 本题考查了盐的水解原理及其应用、溶液酸碱性与溶液pH的关系,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理及其影响,试题充分培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4.标准状况下,112ml,某气体的质量为0.29g,该气体的摩尔质量约为( )
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
17.常温下,将0.1000mol•L-1NaOH溶液滴入20.0mL0.1000mol•L-1的一元酸HA溶液中,测得混合溶液的PH变化曲线如图所示,下列说法正确的是( )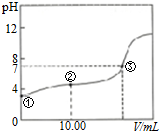

| A. | 两溶液反应的离子方程式是H++OH-+H2O | |
| B. | 图中②点所示溶液中:2c(Na+)=c(HA)+c(A-) | |
| C. | 图中②点所示溶液中:c(A-)>c(H+)>c(HA)>c(OH-) | |
| D. | 图中③点所示滴入的NaOH溶液的体积V=20.00mL |
11.某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种.向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
| A. | 一定有S2-、SO32-、Na+ | B. | 一定没有Ag+、Al3+ | ||
| C. | 可能只有Na+、S2-、CO32- | D. | 一定有Na+、S2-、NO3 |
18.化学变化在我们生活中处处可见,利用家庭生活用品不能够完成的探究性实验是( )
| A. | 检验自来水中含有Cl- | B. | 检验鸡蛋壳中含有碳酸盐 | ||
| C. | 检验加碘食盐中加的不是碘单质 | D. | 除去热水瓶中的水垢 |
15.外界条件相同的理想气体,决定其所占体积大小的主要因素是( )
| A. | 分子直径的大小 | B. | 分子数目的多少 | ||
| C. | 组成分子的原子个数 | D. | 分子间距离的大小 |
16.含有碳碳单键、双键交替的有机物可看作有“共轭”结构,以下有这种结构的是( )
| A. | 苯乙烯 | B. | 1,3-环己二烯 | C. | 天然橡胶 | D. | 聚乙炔 |