题目内容
16.X、Y、Z在元素周期表中的位置如图所示,已知非金属元素X有多中单质,其中一种常用做电极材料,下列说法中正确的是( )| X | Y | |
| Z |
| A. | X、Y的最高价氧化物溶于水后的溶液一定显酸性 | |
| B. | 原子半径由大到小的顺序:Z>X>Y | |
| C. | Z的简单离子对水的电离没有影响 | |
| D. | Z的氯化物与氧化物都属于离子化合物 |
分析 非金属元素X有多中单质,其中一种常用做电极材料,则X为C元素,由元素相对位置可知,Y为N元素、Z为Al.
A.X、Y最高价化合物溶于水后溶液不一定呈酸性,可能呈中性或碱性;
B.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.Z的简单离子是Al3+,属于弱离子,弱离子对水的电离有影响;
D.Z的氯化物是氯化铝,氯化铝属于共价化合物.
解答 解:非金属元素X有多中单质,其中一种常用做电极材料,则X为C元素,由元素相对位置可知,Y为N元素、Z为Al.
A.X、Y最高价化合物溶于水后溶液不一定呈酸性,可能呈中性或碱性,如碳酸钠溶液呈碱性、硝酸钠溶液呈中性,故A错误;
B.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Z>X>Y,故B正确;
C.Z的简单离子是Al3+,属于弱离子,铝离子水解生成氢氧化铝而促进水电离,则对水的电离有影响,故C错误;
D.Z的氯化物是氯化铝,氯化铝中只含共价键,所以属于共价化合物,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,明确元素周期表结构、原子结构、物质性质是解本题关键,易错选项是D,注意:不能根据是否含有金属元素判断离子化合物,要根据存在化学键判断离子化合物.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
14.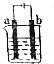 如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
 如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )| A. | H2SO4溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | KOH溶液 |
7.下列微粒在指定条件下能大量共存的一组是( )
| A. | 0.1 mol•L-1NaHCO3溶液中:C6H5O-、K+、Na+、Cl- | |
| B. | 使甲基橙显红色的溶液中:ClO-、I-、Ca2+、Mg2+ | |
| C. | 澄清透明溶液中:Al3+、S2-、NO3-、Cu2+ | |
| D. | 0.1 mol•L-1KMnO4溶液中:H+、SO32-、SO42-、Mn2+、H2C2O4 |
11.下列各组物质中,互为同分异构体的是( )
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH2Cl2与CHCl3 | D. | CH3-CH2-CH2-CH3与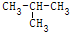 |
8.下列溶剂中,最能溶解离子型溶质的是( )
| A. | CCl4 | B. | CH3OH | C. | C5H12 | D. | (C2H5)2O |
5.常温下,向饱和澄清石灰水中加入少量CaO固体,充分反应后恢复到原来的温度,所得溶液中( )
| A. | c(Ca2+)、c(OH-)均增 | B. | c(Ca2+)、c(OH-)均保持不变 | ||
| C. | c(Ca2+)、c(OH-)均减小 | D. | 溶液质量增大 |