题目内容
8.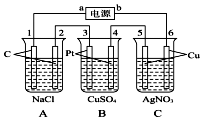 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答:①电源a是负极.
②如果B槽中共收集到224mL气体(标况)且溶液体积为100mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为0.05mol•L-1.
③如果A池溶液是2L(电解过程溶液体积不变),则通电后,pH=12.
分析 A、B、C装置有外接电源,所以是电解池,通电5min后,电极5质量增加2.16g,说明电极5是阴极,得电子析出金属单质,所以a是电源的负极,b是电源的正极,则1、3、5为阴极,发生还原反应,2、4、6发生氧化反应,A电解池中阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,B电解池中阴极上铜离子放电析出铜,阳极上氢氧根离子放电生成氧气,C电解池中阴极上银离子放电析出银,阳极上氢氧根离子放电生成氧气,据此解答该题.
解答 解:①通电5min后,电极5质量增加2.16g,说明电极5是阴极,得电子析出金属单质,所以a是电源的负极,b是电源的正极,
故答案为:负;
②C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.1L}$=0.05 mol•L-1,
故答案为:0.05mol•L-1;
③串联电路中转移电子相等,所以A中转移电子的物质的量也是0.02mol,A电池中电池反应式为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,设反应中生成氢氧化钠的物质的量为x,
2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$H2↑+2NaOH+Cl2↑ 转移电子
2mol 2mol
x 0.02mol
x=0.02mol
c(NaOH)=$\frac{0.02mol}{2L}$=0.01mol/L,所以溶液的pH=12,
故答案为:12.
点评 本题以电解原理为载体考查了物质的量的有关计算,难度不大,明确串联电解池中转移电子数相等是解本题的关键,注意B电解池中气体的成分,然后根据得失电子数相等计算得出铜的物质的量,从而计算得出其浓度.

| A. | 日常生活中使用的硬币都是纯金、白银打造的 | |
| B. | 塑化剂对人体有害,不可用于食品添加剂 | |
| C. | SO2可用于漂白纸张,亦可漂白日常生活中食的馒头 | |
| D. | “药毒三分”其实是没有科学依据的,只要有效超剂里也无所谓 |
| A. | 铁与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 管道煤气燃烧 |
| A. | 17.9mol•L-1 34.7% | B. | 20.4mol•L-1 33.8% | ||
| C. | 17.9mol•L-1 33.8% | D. | 20.4mol•L-1 34.7% |
| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用饱和碳酸钠溶液收集产物 | |
| D. | 制乙烯时,用量程为100℃的温度计代替量程为300℃的温度计,测反应液的温度 |
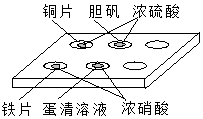 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ①⑤ | D. | ②⑤ |
| A. | $\frac{a}{A+n}$mol | B. | $\frac{a}{A}$mol | C. | $\frac{(A-N+m)a}{A+m}$mol | D. | $\frac{a}{A}$mol |
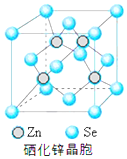 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.