题目内容
11. H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.(1)H2O2溶液显弱酸性,测得0.15mol•L-1H2O2溶液pH约为6.写出H2O2生成HO2-的电离方程式:H2O2?HO2-+H+.
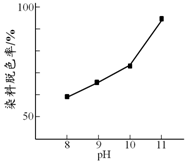
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:由图可得到的结论是其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,结合平衡移动原理简述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大.
(3)实验发现:若pH>11,则H2O2溶液的漂白效果随pH增大而降低.针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关.测定不同初始pH条件下,初始浓度均为0.15mol•L-1的H2O2溶液发生分解反应,结果如表:
| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
①结合离子方程式解释1小时后pH没有明显变化的原因:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变.
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
分析 (1)H2O2溶液显弱酸性,所以H2O2生成HO2-的电离方程式:H2O2?HO2-+H+;
(2)由图可知pH越大染料脱色率越高,因为H2O2溶液显弱酸性,所以碱性越强电离平衡正向移动;
(3)①碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,所以氢氧根离子在反应前后不变;
②由表可知,PH值越大过氧化氢分解的速率越快,所以c(HO2-)下降越快;
解答 解:(1)H2O2溶液显弱酸性,所以H2O2生成HO2-的电离方程式:H2O2?HO2-+H+,故答案为:H2O2?HO2-+H+;
(2)由图可知pH越大染料脱色率越高,因为H2O2溶液显弱酸性,所以碱性越强电离平衡正向移动,结论:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,原因:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大,漂白效果越好,故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大;
(3)①碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,所以氢氧根离子在反应前后不变;故答案为:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变;
②由表可知,PH值越大过氧化氢分解的速率越快,所以c(HO2-)下降越快,故答案为:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
点评 本题考查影响化学平衡的移动,较好的考查学生实验设计、数据处理、图象分析的综合能力,难度中等,注意信息的利用即可解答.

| A. | HCl | B. | H2SO4 | C. | 氨水 | D. | NaOH |
 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )| A. | X表示温度 | B. | L2>L1 | C. | 反应速率 υ(M)>υ(N) | D. | 平衡常数 K(M)>K(N) |
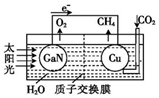 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应:2H2O-4 e-═O2↑+4H+ | |
| C. | Cu表面的反应是:CO2+8e-+6H2O═CH4+8OH? | |
| D. | H+透过质子交换膜从左向右迁移 |
| A. | 铜与硝酸反应 | B. | 钠与氧气反应 | ||
| C. | 氢气与氯气反应 | D. | 氯化铝与氢氧化钠溶液反应 |
| A. | 皮肤上不慎沾上浓Na OH溶液,立即用稀硫酸冲洗 | |
| B. | 大量氯气泄漏时,应迅速离开现场,并尽快往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 金属钠着火时,应立即用沾水的毛巾覆盖 |
| A. | 电子层 | B. | 电子层和能级 | ||
| C. | 电子层、能级和原子轨道空间分布 | D. | 原子轨道空间分布和电子自旋方向 |
| 编号 | 试剂 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在带橡皮塞的细口瓶中,密封 | 防止与空气接触被氧化和与二氧化碳接触而变质 |
| B | 硫酸亚铁晶体 | 存放在带玻璃塞的广口瓶中,密封 | 防止与空气接触被氧化 |
| C | 浓硫酸 | 密闭保存 | 防止吸水和挥发 |
| D | 新制的溴水 | 存放在无色试剂瓶中,密封 | 防止挥发 |
| A. | A | B. | B | C. | C | D. | D |