题目内容
1.实验室里保存下列试剂,其保存的方法和理由,描述都正确的是( )| 编号 | 试剂 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在带橡皮塞的细口瓶中,密封 | 防止与空气接触被氧化和与二氧化碳接触而变质 |
| B | 硫酸亚铁晶体 | 存放在带玻璃塞的广口瓶中,密封 | 防止与空气接触被氧化 |
| C | 浓硫酸 | 密闭保存 | 防止吸水和挥发 |
| D | 新制的溴水 | 存放在无色试剂瓶中,密封 | 防止挥发 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水玻璃具有粘合性;
B.硫酸亚铁具有还原性,易被氧化;
C.浓硫酸不挥发;
D.溴水中HBrO光照分解.
解答 解:A.水玻璃具有粘合性,则存放在带橡皮塞的细口瓶中,密封,不能被氧化,故A错误;
B.硫酸亚铁具有还原性,易被氧化,则存放在带玻璃塞的广口瓶中,密封,故B正确;
C.浓硫酸不挥发,具有吸水性,则密闭保存,故C错误;
D.溴水中HBrO光照分解,则存放在棕色试剂瓶中,密封,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质性质、发生的反应、试剂保存为解答的关键,侧重分析与实验能力的考查,注意实验与元素化合物知识的结合,题目难度不大.

练习册系列答案
相关题目
11. H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
(1)H2O2溶液显弱酸性,测得0.15mol•L-1H2O2溶液pH约为6.写出H2O2生成HO2-的电离方程式:H2O2?HO2-+H+.
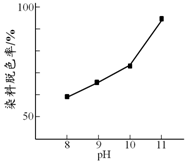
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:由图可得到的结论是其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,结合平衡移动原理简述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大.
(3)实验发现:若pH>11,则H2O2溶液的漂白效果随pH增大而降低.针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关.测定不同初始pH条件下,初始浓度均为0.15mol•L-1的H2O2溶液发生分解反应,结果如表:
查阅资料:HO2-+H2O2═H2O+O2+OH-.
①结合离子方程式解释1小时后pH没有明显变化的原因:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变.
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.(1)H2O2溶液显弱酸性,测得0.15mol•L-1H2O2溶液pH约为6.写出H2O2生成HO2-的电离方程式:H2O2?HO2-+H+.
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:由图可得到的结论是其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,结合平衡移动原理简述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大.
(3)实验发现:若pH>11,则H2O2溶液的漂白效果随pH增大而降低.针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关.测定不同初始pH条件下,初始浓度均为0.15mol•L-1的H2O2溶液发生分解反应,结果如表:
| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
①结合离子方程式解释1小时后pH没有明显变化的原因:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变.
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
9.下列说法不正确的是( )
| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氯化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | Fe、Cu分别与Cl2反应,均生成高价氯化物 |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L |
6.下列属于碱的是( )
| A. | NH3•H2O | B. | MnO2 | C. | HNO3 | D. | NaHCO3 |
13.下列离子方程式不正确的是( )
| A. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 硫酸铵稀溶液和稀氢氧化钡溶液反应:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| C. | 把氯气通入NaOH 溶液中:Cl2+2OH-═Cl-+ClO-+2H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH-═H2O+CaCO3↓ |
19.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 漂白粉溶液中:K+、Na+、I-、CO32- | |
| D. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、CO32- |
 .
.