题目内容
7.六水氯化锶(SrCl2•6H2O)是实验室重要的分析试剂,其工业生产流程如下图所示: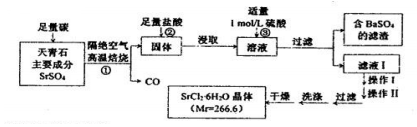
请按要求回答下列问题:
(1)锶(Sr)与Mg同主族,比Mg周期数大2,Sr的原子序数为38.
(2)天青石在燃烧前应进行的操作是粉碎.
反应①中仅有S元素被还原,且1molS转移8mole-.写出该反应的化学方程式:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(3)反应②中盐酸不宜过稀的原因是盐酸过量会使反应②的速率过慢.反应③中硫酸的作用是除去溶液中Ba2+杂质.操作Ⅰ、Ⅱ分别是蒸发浓缩、冷却结晶.
(4)滤液I中Ba2+浓度为1×10-5mol/L;为了提高原料的利用率,滤液Ⅰ中Sr2+的浓度应不高于0.03mol/L.【已知:Ksp(BaSO4)=1.1×10-10,Ksp(SrSO4=3.3×10-7】
(5)测产品纯度:称取2.000g样品溶解于适量水中,向其中加入10.00mL 1.200mol/LAgNO3溶液,再稀硝酸酸化,待Cl-完全沉淀后(设溶液中除Cl-外,不含其它与Ag+反应的离子),用含Fe3+的溶液作指示剂,再用0.1000mol/L的NH4SCN标准溶液滴定剩余的Ag+,以AgSCN白色沉淀的形式析出,消耗标准液20.00mL.
①滴定终点时的现象是:滴入最后一滴NH4SCN溶液,溶液由无色突然变为血红色,且30 s不褪色.
②接近终点时,须轻轻摇动锥形瓶,而不得剧烈摇动,否则会使样品纯度测定值偏低,这说明Ksp(AgCl)>Ksp(AgSCN)(填“>”或“<”).
③所得产品样品的纯度为66.6%.
分析 以天青石(主要成分为SrSO4)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,过滤1后的滤液中含有氯化锶,将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O.
(1)处于过渡元素之前的同主族相邻的3、4两周期元素原子序数差8,相邻的4、5两周期元素原子序数差18;
(2)天青石在燃烧前应进行研磨粉碎,目的是增加反应物的接触面积;SrSO4中只有S被还原,1mol的S转移8mol的电子,反应后生成的-2价硫离子,据此写出该反应的化学方程式;
(3)盐酸过量会使反应②的速率过慢,用HCl溶解SrS后的溶液中含有杂质钡离子,加入硫酸的后生成硫酸钡沉淀从而除去溶液中Ba2+杂质;过滤1后的滤液中含有氯化锶,将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O;
(4)由Ba2+浓度及硫酸钡溶度积计算溶液中SO42-的浓度,再根据SrSO4的溶度积计算滤液中Sr2+的最大浓度;
(5)①反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后溶液变化为血红色证明反应达到终点;
②组成相似的难溶电解质,溶解度与溶度积成正比,则Ksp越大溶解度越大,此现象说明AgCl沉淀会转化为AgSCN沉淀;?
③根据关系式NH4SCN~AgNO3可知,计算过量的AgNO3的物质的量,而AgNO3总物质的量为0.012 mol,所以得到与SrCl2反应的AgNO3物质的量计算纯度.
解答 解:(1)锶(Sr)与Mg同主族,比Mg周期数大2,Sr在Mg的下两个周期,Mg的原子序数为12,则Sr的原子序数为12+8+18=38,
故答案为:38;
(2)天青石焙烧前先研磨粉碎,其目的是为了增加反应物的接触面积,提高化学反应速率,从而提高原料的转化率,在焙烧的过程中若只有S被还原,1mol的S转移8mol的电子,由于在反应前元素的化合价为+6价,所以反应后元素的化合价为-2价,因此碳与天青石在高温下发生反应的化学方程式为:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,
故答案为:粉碎;SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;
(3)SrS加盐酸:SrS+2HCl=SrCl2+H2S↑,盐酸不宜过稀,否则盐酸过量会使反应速率过慢,在用HCl溶解SrS后的溶液中加入硫酸的目的是除去溶液中Ba2+杂质,过滤后滤渣为硫酸钡,过滤1后的滤液中含有氯化锶,将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,
故答案为:盐酸过量会使反应②的速率过慢;除去溶液中Ba2+杂质;蒸发浓缩、冷却结晶;
(4)由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-5}}$mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=$\frac{3.3×1{0}^{-7}}{1.1×1{0}^{-5}}$mol/L=0.03mol/L,
故答案为:0.03mol/L;
(5)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时:滴入最后一滴NH4SCN溶液,溶液由无色突然变为血红色,且30 s不褪色,
故答案为:滴入最后一滴NH4SCN溶液,溶液由无色突然变为血红色,且30 s不褪色;
②到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,AgCl沉淀会转化为AgSCN沉淀,组成相似的难溶电解质,溶解度与溶度积成正比,则Ksp越大溶解度越大,这说明Ksp(AgCl)>Ksp(AgSCN),剧烈摇动,误差会使n(Cl-)测定值偏低,
故答案为:>;
③根据关系式NH4SCN~AgNO3可知,过量的AgNO3的物质的量为0.1 mol/L×0.02 L=0.002mol,而AgNO3总物质的量为0.012 mol,所以与SrCl2反应的AgNO3物质的量为0.01 mol,求出n?SrCl2?=0.005 mol,原氯化锶样品的纯度=$\frac{0.005mol×(87.6+71+108)g/mol}{2g}$×100%≈66.6%,
故答案为:66.6%.
点评 本题考查六水氯化锶制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,涉及原子序数、反应速率、氧化还原反应、滴定原理等,注意信息与所学知识的综合应用,综合性较强,题目难度中等.

| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 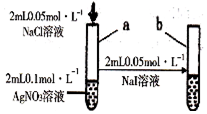 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
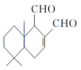 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种数减少,则该试剂是( )| A. | H2 | B. | Cu(OH)2悬浊液 | C. | HBr | D. | Br2的CCl4溶液 |
| A. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
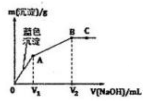 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )| A. | 水的电离程度:A>B>C | |
| B. | 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 | |
| C. | 原溶液中MgCl2和CuCl2的物质的量浓度相等 | |
| D. | 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成 |
| A. | 高价铁盐可用于硬水的软化 | |
| B. | 钾、钠、镁等活泼金属着火时.不能用泡沫灭火器灭火 | |
| C. | 生产水泥和玻璃均可用到碳酸钙 | |
| D. | 石英砂可用干生产粗硅 |
| 事 实 | 结 论 | |
| A | CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O | 酸性:CH3COOH>H2CO3 |
| B | 氢硫酸(H2S)放置在空气中变浑浊 | 氧化性:O2>S |
| C | Al(OH)3既溶于强酸又溶于强碱 | Al元素既有金属性也有非金属性 |
| D | 反应A+2B?C达平衡后,升高温度平衡正向移动 | 升高温度,使v正增大、v逆减小 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 化学反应速率发生了改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 某一条件的改变,使正、逆反应速率不再相等 | |
| D. | 可逆反应达到平衡,使用了催化剂 |
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 |